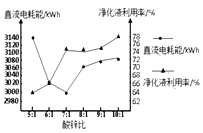
题目内容
【题目】已知25℃时,CH3COONH4溶液呈中性.
Ⅰ.将0.1molL﹣1的CH3COOH溶液与0.1molL﹣1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9.回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因__.
(2)混合后溶液中c(CH3COOH)=__molL﹣1(填写精确值).
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3 ②CH3COONH4 ③(NH4)2SO4 ④NH4Cl,pH由大到小的排列顺序为__(填序号).
Ⅱ.Mg(OH)2沉淀可溶解于NH4Cl溶液.同学对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH﹣导致沉淀溶解;乙同学认为是NH4+与Mg(OH)2电离出的OH﹣反应生成弱电解质NH3·H2O,导致沉淀溶解.
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是__
A.NH4NO3 B.CH3COONH4C.Na2CO3 D.NH3·H2O
(5)丙同学选择该试剂的理由是:__.
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,由此可知:__(填“甲”或“乙”)的解释更合理.Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:__.
(7)现有Mg(OH)2和Al(OH)3沉淀的混合物,若除去Mg(OH)2得到纯净的Al(OH)3,可用__(填写所用试剂的化学式,试剂从本题涉及的试剂中选取,下同);若除去Al(OH)3得到纯净的Mg(OH)2,可用_______________________________________.
【答案】(1)CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(2)(1×10-5-1×10-9) (3)①②④③(4)B
(5)CH3COONH4溶液呈中性,不存在甲同学观点中条件,以此确认乙同学的观点是否正确
(6)乙 Mg(OH)2+2NH===Mg2++2NH3·H2O
(7)NH4NO3 (或CH3COONH4等铵盐均可) NaOH
【解析】
试题Ⅰ.(1)将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合,发生反应:CH3COOH+NaOH=CH3COONa+H2O,反应后变成CH3COONa溶液,而醋酸根水解:CH3COO-+H2O![]() CH3COOH+OH-,使溶液呈碱性,所以pH=9。
CH3COOH+OH-,使溶液呈碱性,所以pH=9。
(2)将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合,发生反应:CH3COOH+NaOH=CH3COONa+H2O,反应后变成CH3COONa溶液,而醋酸根水解:CH3COO-+H2O![]() CH3COOH+OH-,pH=9,说明溶液中c(H+)=10-9,所以c(OH-)=10-5,水电离出的c(OH-)= c(H+)=10-9,所以醋酸根水解出的c(OH-)= c(H+)=10-5-10-9,c(CH3COOH)=醋酸根水解出的c(OH-)= c(H+)=10-5-10-9。
CH3COOH+OH-,pH=9,说明溶液中c(H+)=10-9,所以c(OH-)=10-5,水电离出的c(OH-)= c(H+)=10-9,所以醋酸根水解出的c(OH-)= c(H+)=10-5-10-9,c(CH3COOH)=醋酸根水解出的c(OH-)= c(H+)=10-5-10-9。
(3)②CH3COONH4④NH4Cl中铵根离子浓度系数都是1,醋酸根离子促进铵根离子水解,所以②CH3COONH4中铵根离子浓度小于④NH4Cl中;①(NH4)2CO3③(NH4)2SO4中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度,碳酸根离子促进铵根离子水解,则溶液中铵根离子浓度从小到大顺序是①②④③。
Ⅱ.(4)CH3COONH4溶液呈中性,不可能是溶液的水解产生的酸碱性影响Mg(OH)2沉淀的溶液,不存在甲同学观点中条件,以此确认乙同学的观点是否正确,所以选B.
(5)CH3COONH4溶液呈中性,不可能是溶液的水解产生的酸碱性影响Mg(OH)2沉淀的溶液,不存在甲同学观点中条件,以此确认乙同学的观点是否正确.
(6) CH3COONH4溶液呈中性,不可能是溶液的水解产生的酸碱性影响Mg(OH)2沉淀的溶液,加入后Mg(OH)2溶解,说明是NH与Mg(OH)2电离出的OH-反应生成弱电解质NH3·H2O,导致沉淀溶解,乙同学的正确;Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:Mg(OH)2+2NH===Mg2++2NH3·H2O。
(7)据以上分析若除去Mg(OH)2得到纯净的Al(OH)3,加入铵盐即可;因为氢氧化铝与氢氧化钠溶液反应,而与氢氧化镁不反应,若除去Al(OH)3得到纯净的Mg(OH)2,加氢氧化钠在过滤即可。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
【题目】实验室模拟侯氏制碱法原理,可以制备一些常见的化合物。
i. 30℃时,向饱和NaCl溶液中加入NH4HCO3细粉,制备NaHCO3晶体。
(1)已知30℃时几种盐的溶解度为:
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
S(g/100gH2O) | 36.3 | 27.0 | 11.1 | 41.1 |
书写化学方程式_______________________。根据反应原理结合信息解释NaHCO3易析出的原因__________________________。
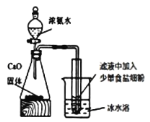
(2)过滤出NaHCO3晶体后,为继续分离滤液中的物质,设计如图装置。左侧发生装置可制取氨气,原因是_____________。一段时间后,试管中析出白色晶体为_______。用冰水浴降温目的是_____________。
ii. 制取(NH4)2SO4晶体的流程如下:
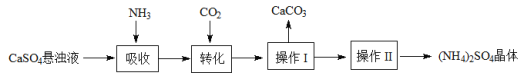
(3)“转化”步骤中CO2不宜过量,原因是__________________。
(4)操作I和II所需的实验步骤顺序是____________(选填编号,可重复选择)。
a. 蒸发浓缩 b. 蒸馏 c. 过滤 d. 萃取 e. 分液 f. 冷却结晶
(5)为测定某硫酸铵样品(杂质为碳酸铵)纯度。先准确称取5.000g样品溶于水,加入足量的_______,再加入足量BaCl2溶液充分反应后过滤、洗涤沉淀并烘干至恒重,最终所得固体为8.155g。则硫酸铵样品的纯度为___________。