题目内容
13.(1)常温下将0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:①混合溶液中由水电离出的c(H+)>0.2mol•L-1HCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)=9.9×10-7mol•L-1.(填精确计算结果)
(2)常温下若将0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1000mol•L-1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
②下列情况可能引起测定结果偏高的是A C.
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.
分析 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成MCl,测得混合溶液的pH=6,溶液呈酸性,说明MOH为强电解质,M+在溶液中部分水解,溶液呈酸性,
①混合液中M+在溶液中部分水解,促进了水的电离,而盐酸中氢离子抑制了水的电离;
②根据混合液中的电荷守恒、物料守恒进行计算;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性;
(4)①先根据数据的有效性,然后求出平均消耗V(NaOH),接着根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$来计算;
②实验操作过程中的错误操作都可以归结为消耗标准溶液的体积来分析产生的误差,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$来分析选项.
解答 解:常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成MCl,测得混合溶液的pH=6,溶液呈酸性,说明MOH为强电解质,M+在溶液中部分水解,溶液呈酸性,
①混合液为MCl溶液,由于M+在溶液中部分水解,促进了水的电离,盐酸中氢离子抑制了水的电离,则混合溶液中由水电离出的c(H+)>HCl溶液中由水电离出的c(H+),
故答案为:>;
②混合液的pH=6,则c(H+)=1×10-6mol/L,c(OH-)=1×10-8mol/L,根据电荷守恒c(Cl-)+c(OH-)=c(M+)+c(H+)可知:c(Cl-)-c(M+)=c(H+)-c(OH-)=1×10-6mol/L-1×10-8mol/L=9.9×10-7 mol/L;
故答案为:9.9×10-7;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度,
故答案为:<;
(3)HR若为强电解质,二者都是一元酸或碱,等体积混合后溶液的pH=7,而混合溶液的pH≠7,说明HR为弱电解质,二者混合后溶液中酸过量,反应后溶液显示酸性,溶液pH<7,
故答案为:<7;
(4)①三次滴定消耗的体积为:27.83mL,25.53mL,27.85mL,数据25.53mL误差较大,此数据无效,则平均消耗V(NaOH)=$\frac{27.83+27.85}{2}$ml=27.84mL,
c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$=(待测)=$\frac{0.1000mol/L×27.84×1{0}^{-3}L}{0.0200L}$=0.1392mol•L-1,
故答案为:0.1392;
②A.酸式滴定管未用标准盐酸溶液润洗,溶液被内壁水膜稀释,消耗标准溶液体积增大,测定浓度偏高,故A正确;
B.锥形瓶未用待测液润洗是正确操作,测定结果正确,故B错误;
C.到达滴定终点时,仰视读数,读取标准溶液体积增大,测定结果偏高,故C正确;
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.读数正确对测定结果无影响,故D错误;
故答案为:A C.
点评 本题考查了酸碱混合的定性判断及有关pH的计算,题目难度中等,注意掌握电荷守恒、物料守恒、质子守恒的含义及应用方法,明确酸碱混合的定性判断方法及溶液pH的计算方法,误差分析是解题关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案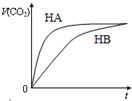 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )| A. | 物质酸性的比较:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中,c(B-)>c(A-) | |
| C. | 上述三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HB溶液>HA溶液 | |
| D. | HA溶液和NaHCO3溶液反应所得溶液中:c(A-)+c(HA)=0.10mol/L |
(1)雷雨天气中发生自然固氮后,氮元素转化为硝酸盐而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ•mol-1 K1②
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{{K}_{1}}^{2}}{{{K}_{2}}^{3}}$(用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为3×10-4%;与前三组相比,第四组反应中NH3生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
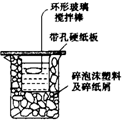 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是温度计.
(2)他们记录的实验数据如表中所示.已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.则中和热△H=-55.2kJ/mol(取小数点后1位);根据实验结果用离子方程式表示上述反应中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-55.2kJ/mol.
| 实验 序号 | 起始温度 平均值t1 | 终止温度 t2 |
| 1 | 20℃ | 23.2℃ |
| 2 | 20℃ | 23.4℃ |
A.所有酸、碱稀溶液反应的中和热相等
B.准确测定中和热的实验中,至少需测定温度4次
C.烧杯之间用纸屑填充的目的是为了避免实验测定的△H偏高
D.若改用60mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液进行上述反应,从理论上说,放出的热量相等.
①氧化剂是HNO2
②还原性:Cl->N2
③每生成2.8g N2,还原剂失去的电子为0.6mol
④x为4,y为2
⑤SnCl${\;}_{x}^{y-}$是氧化产物.
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 只有①③ |
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
(2)上述四种物质在液氨中发生的复分解反应的化学方程式为Ba(NO3)+2AgCl=2AgNO3+BaCl2↓.
| A. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| B. | 一种元素被氧化,肯定有另一种元素被还原 | |
| C. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 |