题目内容
【物质结构与性质】
如图1是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难.对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 .
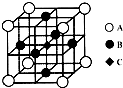
(4)B单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 .
如图1是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素D的基态原子电子排布式
(2)D、E两元素的部分电离能数据列于下表:
| 元 素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)A的氢化物的中心原子的杂化形式为
(4)B单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.晶胞中B原子的配位数为
分析:由元素在周期表中的位置可知,A为N、B为Al、C为S、D为Mn、E为Fe,
(1)Mn元素原子核外电子数为25,结合能量最低原理书写;
(2)根据Mn2+、Fe2+失去的1的电子所处的能级是否为半满、全满稳定状态判断;
(3)A的氢化物是NH3,计算中心N原子的价层电子对数确定杂化方式;C在空气中燃烧产物是SO2,计算中心S原子的价层电子对数、孤对电子,确定其空间构型,原子数目相同、价电子总数相同的微粒为等电子体,将S原子换成O原子可得其等电子体单质;
(4)由图可知Al的单质晶体为面心立方最密堆积,以定点Al原子为研究对象,与之最近的Al原子位于面心,每个定点Al原子为12个面共用,据此判断配位数,根据均摊法计算晶胞中Al原子数目.
(1)Mn元素原子核外电子数为25,结合能量最低原理书写;
(2)根据Mn2+、Fe2+失去的1的电子所处的能级是否为半满、全满稳定状态判断;
(3)A的氢化物是NH3,计算中心N原子的价层电子对数确定杂化方式;C在空气中燃烧产物是SO2,计算中心S原子的价层电子对数、孤对电子,确定其空间构型,原子数目相同、价电子总数相同的微粒为等电子体,将S原子换成O原子可得其等电子体单质;
(4)由图可知Al的单质晶体为面心立方最密堆积,以定点Al原子为研究对象,与之最近的Al原子位于面心,每个定点Al原子为12个面共用,据此判断配位数,根据均摊法计算晶胞中Al原子数目.
解答:解:由元素在周期表中的位置可知,A为N、B为Al、C为S、D为Mn、E为Fe,
(1)Mn元素原子核外电子数为25,能量最低原理可知,其原子核外电子排布为:1s22s22p63s23p63d54s2,
故答案为:1s22s22p63s23p63d54s2;
(2)Mn2+的3d轨道电子排布为半满状态较稳定,能量较低,而Fe2+的3d轨道电子排布不是稳定状态,能量相对较高,故Mn2+比Fe2+更难失去1个电子,
根据Mn2+、Fe2+失去的1的电子所处的能级是否为半满、全满稳定状态判断;
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定能量较低,而Fe2+的3d轨道电子排布不是稳定状态,能量相对较高;
(3)A的氢化物是NH3,中心N原子的价层电子对数=3+
=4,故N原子杂化方式为sp3;C在空气中燃烧产物是SO2,中心S原子的价层电子对数=2+
=3、含有1对孤对电子,故其其空间构型为V型,原子数目相同、价电子总数相同的微粒为等电子体,将S原子换成O原子可得其等电子体单质O3,
故答案为:sp3;V型;O3;
(4)由图可知Al的单质晶体为面心立方最密堆积,以定点Al原子为研究对象,与之最近的Al原子位于面心,每个定点Al原子为12个面共用,故配位数为12,均摊法可知晶胞中Al原子数目=8×
+6×
=4,
故答案为:12;4.
(1)Mn元素原子核外电子数为25,能量最低原理可知,其原子核外电子排布为:1s22s22p63s23p63d54s2,
故答案为:1s22s22p63s23p63d54s2;
(2)Mn2+的3d轨道电子排布为半满状态较稳定,能量较低,而Fe2+的3d轨道电子排布不是稳定状态,能量相对较高,故Mn2+比Fe2+更难失去1个电子,
根据Mn2+、Fe2+失去的1的电子所处的能级是否为半满、全满稳定状态判断;
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定能量较低,而Fe2+的3d轨道电子排布不是稳定状态,能量相对较高;
(3)A的氢化物是NH3,中心N原子的价层电子对数=3+
| 5×3 |
| 2 |
| 6-2×2 |
| 2 |
故答案为:sp3;V型;O3;
(4)由图可知Al的单质晶体为面心立方最密堆积,以定点Al原子为研究对象,与之最近的Al原子位于面心,每个定点Al原子为12个面共用,故配位数为12,均摊法可知晶胞中Al原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:12;4.
点评:本题考查物质结构与性质,涉及元素周期表、核外电子排布、电离能、杂化轨道、分子结构、等电子体、晶胞结构及计算等,难度不大,侧重对基础知识的巩固利用,注意等电子体为原子数目相同、电子总数或价电子总数相同微粒.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目


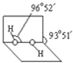 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
 (2013?南通一模)【物质结构与性质】
(2013?南通一模)【物质结构与性质】

 【物质结构与性质】
【物质结构与性质】