题目内容
【题目】下列实验装置图合理的是

A. 装置①可实现:Cu+2H2O![]() Cu(OH)2+H2↑
Cu(OH)2+H2↑
B. 装置②能构成锌铜原电池
C. 装置③可用于粗铜的电解精炼
D. 装置④可用于浓硫酸干燥氯气
【答案】A
【解析】A、铜连接电源的正极,因此铜作阳极,电极反应式为Cu-2e-=Cu2+,石墨连接电源的负极,石墨作阴极,电极反应式为2H2O+2e-=H2↑+2OH-,电解反应方程式为Cu+2H2O![]() Cu(OH)2+H2↑,故A正确;B、不能构成原电池,在左端烧杯中发生Zn+Cu2+=Zn2++Cu,构成原电池:应是左端烧杯盛放ZnSO4,右端烧杯盛放CuSO4,故BC错误;C、精炼铜时,粗铜作阳极,纯铜作阴极,故C错误;D、洗气时,应是长管进气,短管出气,故D错误。
Cu(OH)2+H2↑,故A正确;B、不能构成原电池,在左端烧杯中发生Zn+Cu2+=Zn2++Cu,构成原电池:应是左端烧杯盛放ZnSO4,右端烧杯盛放CuSO4,故BC错误;C、精炼铜时,粗铜作阳极,纯铜作阴极,故C错误;D、洗气时,应是长管进气,短管出气,故D错误。

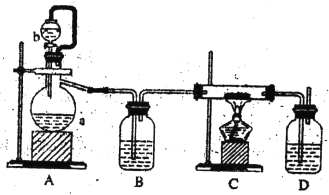
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:

(1)水从冷凝管的______(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | ﹣ |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于__________反应(填字母)。
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是______(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):___________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)欲分离出乙酸乙酯,应使用的分离方法是__________(填操作方法名称,下同),所用到的仪器为______ , 进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法。
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是_______。
(6)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式____________________。