题目内容
将Cu、Cu2O和 CuO均匀混合物分成两等份,其中一份用足量的CO还原,测得反应后固体质量减少6.4g,另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,且同时收集到标准状况下NOX气体6.72L,则所用硝酸的物质的量浓度可能为
| A.8.0mol·L-1 | B.9.0mol·L-1 | C.10.0mol·L-1 | D.11.0mol·L-1 |
CD
解析试题分析:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的CO气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为6.4/16=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NOX气体6.72L,,NOX的物质的量为6.72/22.4=0.3mol,若为NO:则根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.3mol,n(Cu)=0.45mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.45mol=0.85mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.3mol+2×0.85mol=2mol,硝酸的浓度为2/0.15=11.3mol/L。若为NO2:则根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=n(NO2)=0.3mol,n(Cu)=0.15mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.15mol=0.55mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.3mol+2×0.55mol=1.4mol,硝酸的浓度为1.4/0.15=9.3mol/L。故选:A.故硝酸的物质的量浓度可能为10.0mol·L-1和11.0mol·L-1之间。
考点:本题考查了混合物的计算、守恒计算等。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )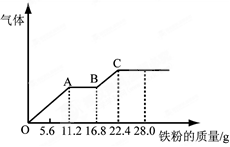
| A.H2SO4浓度为2.5 mol·L-1 |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.混合酸中NO3-物质的量为0.4mol |
下列叙述正确是的
| A.人工固氮的过程一定涉及到氧化还原反应 |
| B.1mol氯气在反应中一定得到2mol电子 |
| C.1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 |
| D.发生化学反应时,失去电子越多的金属原子,还原能力越强 |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+ 3H++ NO3-→ Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH+ Cl2→ CuCl+ HCl |
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列判断正确的是
| A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:C1->CN- |
高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式: 2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4。有关分析错误的是
| A.等物质的量Na2FeO4氧化能力优于次氯酸钠 |
| B.湿法中氢氧化铁被氧化 |
| C.干法中每生成1 mol Na2FeO4转移3 mol电子 |
| D.高铁酸钠的氧化性大于次氯酸钠 |
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是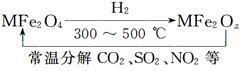
| A.MFe2O4在与H2的反应中表现了氧化性 |
| B.MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C.MFe2Ox与SO2反应中MFe2Ox被还原 |
| D.若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是( )
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+3H++NO3—=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
三氟化氮(NF3)(提示氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2molHNO3,则转移0.2mol电子 |
| D.若1molNF3被氧化反应转移电子数为2NA |