题目内容
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是
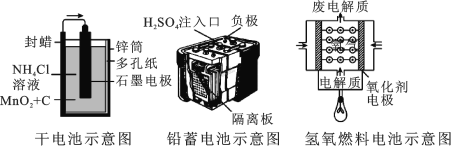
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒变软
C.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
D.碱性氢氧燃料电池负极反应式为:H2-2e-+2OH- = 2H2O
【答案】C
【解析】
A. 干电池放电后不能再次复原,属于一次电池,铅蓄电池在放电后可以充电继续使用,属于二次电池,氢氧电池能够把燃料的化学能转化为电能,属于燃料电池,故A正确;
B. 在干电池的使用过程中,Zn为负极,失去电子被氧化,因此锌筒被消耗会慢慢变软,故B正确;
C. 铅蓄电池工作时负极的反应为:![]() ,每通过2mol电子消耗1molPb,同时生成1molPbSO4,附着在负极上,因此每通过 2 mol 电子,负极Pb的质量减轻207 g,同时生成了303g PbSO4,因此负极质量增加96g,故C错误;
,每通过2mol电子消耗1molPb,同时生成1molPbSO4,附着在负极上,因此每通过 2 mol 电子,负极Pb的质量减轻207 g,同时生成了303g PbSO4,因此负极质量增加96g,故C错误;
D. 碱性氢氧燃料电池,燃料做负极失去电子,负极反应式为:H2-2e-+2OH- = 2H2O,故D正确;
答案选C。

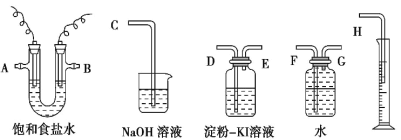
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。