题目内容
(7分)有一无色透明溶液,,可能含有Na+、K+、Fe2+、Ba2+、NO3-、SO32-、SO42-离子中的若干种,依次进行下列实验,观察到的现象如下。
①取少量该溶液,滴加氯水,氯水褪色。
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③用洁净的铂丝蘸取该溶液,在酒精灯火焰上灼烧,火焰呈黄色
④取少量该溶液,加入足量BaCl2溶液,产生白色沉淀,再加足量稀硝酸,沉淀不溶解。
根据上述实验现象判断:
(1)溶液中肯定存在的离子是 。
(2)溶液中可能存在的离子是 。
(3)为进一步确定可能存在的离子,应该补充的实验是 。
①取少量该溶液,滴加氯水,氯水褪色。
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③用洁净的铂丝蘸取该溶液,在酒精灯火焰上灼烧,火焰呈黄色
④取少量该溶液,加入足量BaCl2溶液,产生白色沉淀,再加足量稀硝酸,沉淀不溶解。
根据上述实验现象判断:
(1)溶液中肯定存在的离子是 。
(2)溶液中可能存在的离子是 。
(3)为进一步确定可能存在的离子,应该补充的实验是 。
(1)Na+、NO3-、SO32-(2分)(若少一个离子扣1分,有一个离子填错,不得分)
(2)K+、SO42-(2分)(若少一个离子扣1分,有一个离子填错,不得分)
(3)焰色反应(透过蓝色的钴玻璃观察火焰呈紫色)(1分),取少量原溶液,加入过量的盐酸溶液后,取上层清液加入Ba(NO3)2溶液,有白色沉淀生成(2分)
(2)K+、SO42-(2分)(若少一个离子扣1分,有一个离子填错,不得分)
(3)焰色反应(透过蓝色的钴玻璃观察火焰呈紫色)(1分),取少量原溶液,加入过量的盐酸溶液后,取上层清液加入Ba(NO3)2溶液,有白色沉淀生成(2分)
因为是无色透明溶液,属于亚铁离子没有。滴加氯水,氯水褪色,说明含有还原性离子,因此一定含有SO32-。因为Ba2+和SO32-不能大量共存,所以一定没有Ba2+。有无色气体产生,后在空气中又变成红棕色,所以气体是NO,被氧化生成NO2,因此实验②说明含有NO3-。实验③说明含有Na+。实验④中的白色沉淀是硫酸钡,但由于前面的实验中SO32-被氧化生成了SO42-,实验无法证明是否含有SO42-。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
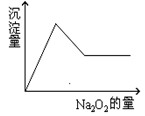
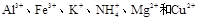 等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。