题目内容
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。

(1) 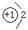 (1分)
(1分) 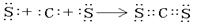 (2分)
(2分)
(2)S2->Na+>Al3+ (2分) HCl(2分)
(3)H-C≡C-H (1分) C2H2 + 4H2O ? 10e-= 2CO2+10H+(2分)
(4)Al(OH)3+OH- =AlO2- +2H2O (2分); NaHS+HCl= NaCl+H2S 或 Na2S + H 2S =2 NaHS(2分)
(5)NaCl+H2O NaClO+H2↑ (2分)
NaClO+H2↑ (2分)
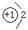 (1分)
(1分) 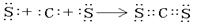 (2分)
(2分)(2)S2->Na+>Al3+ (2分) HCl(2分)
(3)H-C≡C-H (1分) C2H2 + 4H2O ? 10e-= 2CO2+10H+(2分)
(4)Al(OH)3+OH- =AlO2- +2H2O (2分); NaHS+HCl= NaCl+H2S 或 Na2S + H 2S =2 NaHS(2分)
(5)NaCl+H2O
 NaClO+H2↑ (2分)
NaClO+H2↑ (2分) 试题分析:根据丙、丁、戊处于同一周期,且丙、丁、戊的最高价氧化物的水化物之间都能发生反应,可知丁为Al,该三种元素处于第三周期,氢氧化铝能够与强碱和强酸反应,结合题意,原子序数依次增大的短周期主族元素,推出丙为Na,戊为S,己为Cl;根据乙元素最高化合价与最低价的代数和为0,乙为C元素,甲、丙处于同一主族,甲为H元素。(1)氢的阴离子最外层有2个电子,碳和硫之间以共价键形成CS2;(2)根据电子层数越多半径越大,电子层排布相同的离子,离子半径大小与核电荷数大小成反比,即S2->Na+>Al3+ ,氢化物的还原性与非金属性成反比例,非金属性越强,其氢化物的还原性越弱,其还原性顺序:H2S>CH4>HCl;(3)甲、乙两元素形成的化合物属于烃类,含有极性键又含有非极性键,且相对分子质量最小的物质,含2个碳,含H个数最少,综合判断为乙炔,结构简式为:H-C≡C-H ,乙炔燃料电池,负极是乙炔失去电子发生氧化反应,酸性条件下电极反应式为: C2H2 + 4H2O ? 10e-= 2CO2+10H+;(4)氢氧化钠与氢氧化铝反应离子方程式为Al(OH)3+OH- =AlO2- +2H2O ,H、Na、S、Cl形成的化合物,应该是硫化物(H2S、NaHS或Na2S)和氯化物(HCl和NaCl),其中能发生反应的是NaHS+HCl= NaCl+H2S或Na2S + H 2S =2 NaHS;(5)电解饱和氯化钠溶液,阳极在装置的下部,阳极反应生成的氯气往上溢出的过程中与阴极附近的氢氧化钠反应生成次氯酸钠,起到消毒作用,总电解反应为NaCl+H2O
 NaClO+H2↑。
NaClO+H2↑。
练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
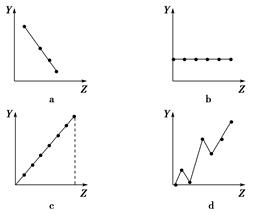
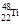 )的说法正确的是:
)的说法正确的是: