题目内容
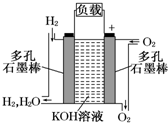
(1)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:①图中通过负载的电子流动方向______(填“向左”或“向右”).
②写出氢氧燃料电池工作时电极反应方程式
正极:______,
负极:______,
(2)在由铜片、锌片和200ml稀硫酸组成的原电池中,若H2只在铜片上产生,当在铜片上放出4.48L(标准状况)的H2时,硫酸恰好用完,则产生这些气体消耗的锌为______g,在导线上有______mol电子通过,原稀硫酸的物质的量浓度是______.
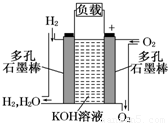
【答案】分析:(1)①根据燃料电池的工作原理来判断电子的流向;
②在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上发生得电子的还原反应,结合电解质环境来书写电极反应式;
(2)根据氢气和锌的关系式计算消耗的锌的质量;根据氢气和转移电子的关系式计算转移电子的量;根据氢气和硫酸的关系式计算硫酸的物质的量,再根据物质的量浓度公式计算硫酸的物质的量浓度;
解答:解:(1)①根据原电池工作原理,负极上失电子,电子从负极沿外电路流向正极,所以通过负载的电子流动方向是向右.故答案为:向右;
②正极上氧气得电子和水生成氢氧根离子,发生还原反应,所以电极反应式为2H2O+O2+4e-═4OH-;负极上失电子和氢氧根离子反应生成水,所以电极反应式为2H2+4OH--4e-═4H2O;两极上的电极反应式相加得总反应方程式,所以总反应方程式为2H2+O2═2H2O,故答案为:2H2O+O2+4e-═4OH-;2H2+4OH--4e-═4H2O;
(2)解:Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
13g 4.48L
(2)Zn+H2SO4 =ZnSO4 +H2↑ 转移电子
22.4L 2 mol
4.48L 0.4mol
故答案为0.3;
(3)Zn+H2SO4 =ZnSO4 +H2↑
1mol 22.4L
0.2mol 4.48L
溶液中硫酸的物质的量为0.2mol;
所以稀硫酸的物质的量浓度C= =
= =1mol/L
=1mol/L
故答案为:13、0.4、1mol/L.
点评:本题考查学生原电池的工作原理并以原电池为载体考查了反应方程式的有关计算,正确找出各物质间的关系是解本题的关键,该题综合性强,难度大.
②在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上发生得电子的还原反应,结合电解质环境来书写电极反应式;
(2)根据氢气和锌的关系式计算消耗的锌的质量;根据氢气和转移电子的关系式计算转移电子的量;根据氢气和硫酸的关系式计算硫酸的物质的量,再根据物质的量浓度公式计算硫酸的物质的量浓度;
解答:解:(1)①根据原电池工作原理,负极上失电子,电子从负极沿外电路流向正极,所以通过负载的电子流动方向是向右.故答案为:向右;
②正极上氧气得电子和水生成氢氧根离子,发生还原反应,所以电极反应式为2H2O+O2+4e-═4OH-;负极上失电子和氢氧根离子反应生成水,所以电极反应式为2H2+4OH--4e-═4H2O;两极上的电极反应式相加得总反应方程式,所以总反应方程式为2H2+O2═2H2O,故答案为:2H2O+O2+4e-═4OH-;2H2+4OH--4e-═4H2O;
(2)解:Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
13g 4.48L
(2)Zn+H2SO4 =ZnSO4 +H2↑ 转移电子
22.4L 2 mol
4.48L 0.4mol
故答案为0.3;
(3)Zn+H2SO4 =ZnSO4 +H2↑
1mol 22.4L
0.2mol 4.48L
溶液中硫酸的物质的量为0.2mol;
所以稀硫酸的物质的量浓度C=
 =
= =1mol/L
=1mol/L故答案为:13、0.4、1mol/L.
点评:本题考查学生原电池的工作原理并以原电池为载体考查了反应方程式的有关计算,正确找出各物质间的关系是解本题的关键,该题综合性强,难度大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: (1)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: