��Ŀ����
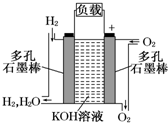
 ��1������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺
��1������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺��ͼ��ͨ�����صĵ�����������
����
����
����������ҡ�������д������ȼ�ϵ�ع���ʱ�缫��Ӧ����ʽ
������
2H2O+O2+4e-�T4OH-
2H2O+O2+4e-�T4OH-
��������
2H2+4OH--4e-�T4H2O
2H2+4OH--4e-�T4H2O
����2������ͭƬ��пƬ��200mlϡ������ɵ�ԭ����У���H2ֻ��ͭƬ�ϲ���������ͭƬ�Ϸų�4.48L����״������H2ʱ������ǡ�����꣬�������Щ�������ĵ�пΪ
13
13
g���ڵ�������0.4
0.4
mol����ͨ����ԭϡ��������ʵ���Ũ����1mol/L
1mol/L
����������1���ٸ���ȼ�ϵ�صĹ���ԭ�����жϵ��ӵ�����
����ȼ�ϵ���У���������ȼ�Ϸ���ʧ���ӵ�������Ӧ�������Ϸ����õ��ӵĻ�ԭ��Ӧ����ϵ���ʻ�������д�缫��Ӧʽ��
��2������������п�Ĺ�ϵʽ�������ĵ�п������������������ת�Ƶ��ӵĹ�ϵʽ����ת�Ƶ��ӵ�������������������Ĺ�ϵʽ������������ʵ������ٸ������ʵ���Ũ�ȹ�ʽ������������ʵ���Ũ�ȣ�
����ȼ�ϵ���У���������ȼ�Ϸ���ʧ���ӵ�������Ӧ�������Ϸ����õ��ӵĻ�ԭ��Ӧ����ϵ���ʻ�������д�缫��Ӧʽ��
��2������������п�Ĺ�ϵʽ�������ĵ�п������������������ת�Ƶ��ӵĹ�ϵʽ����ת�Ƶ��ӵ�������������������Ĺ�ϵʽ������������ʵ������ٸ������ʵ���Ũ�ȹ�ʽ������������ʵ���Ũ�ȣ�
����⣺��1���ٸ���ԭ��ع���ԭ����������ʧ���ӣ����ӴӸ��������·��������������ͨ�����صĵ����������������ң��ʴ�Ϊ�����ң�
�������������õ��Ӻ�ˮ�������������ӣ�������ԭ��Ӧ�����Ե缫��ӦʽΪ2H2O+O2+4e-�T4OH-��������ʧ���Ӻ����������ӷ�Ӧ����ˮ�����Ե缫��ӦʽΪ2H2+4OH--4e-�T4H2O�������ϵĵ缫��Ӧʽ��ӵ��ܷ�Ӧ����ʽ�������ܷ�Ӧ����ʽΪ2H2+O2�T2H2O���ʴ�Ϊ��2H2O+O2+4e-�T4OH-��2H2+4OH--4e-�T4H2O��
��2���⣺Zn+H2SO4 =ZnSO4 +H2��
65g 22.4L
13g 4.48L
��2��Zn+H2SO4 =ZnSO4 +H2�� ת�Ƶ���
22.4L 2 mol
4.48L 0.4mol
�ʴ�Ϊ0.3��
��3��Zn+H2SO4 =ZnSO4 +H2��
1mol 22.4L
0.2mol 4.48L
��Һ����������ʵ���Ϊ0.2mol��
����ϡ��������ʵ���Ũ��C=
=
=1mol/L
�ʴ�Ϊ��13��0.4��1mol/L��
�������������õ��Ӻ�ˮ�������������ӣ�������ԭ��Ӧ�����Ե缫��ӦʽΪ2H2O+O2+4e-�T4OH-��������ʧ���Ӻ����������ӷ�Ӧ����ˮ�����Ե缫��ӦʽΪ2H2+4OH--4e-�T4H2O�������ϵĵ缫��Ӧʽ��ӵ��ܷ�Ӧ����ʽ�������ܷ�Ӧ����ʽΪ2H2+O2�T2H2O���ʴ�Ϊ��2H2O+O2+4e-�T4OH-��2H2+4OH--4e-�T4H2O��
��2���⣺Zn+H2SO4 =ZnSO4 +H2��
65g 22.4L
13g 4.48L
��2��Zn+H2SO4 =ZnSO4 +H2�� ת�Ƶ���
22.4L 2 mol
4.48L 0.4mol
�ʴ�Ϊ0.3��
��3��Zn+H2SO4 =ZnSO4 +H2��
1mol 22.4L
0.2mol 4.48L
��Һ����������ʵ���Ϊ0.2mol��
����ϡ��������ʵ���Ũ��C=
| n |
| V |
| 0.2mol |
| 0.2L |
�ʴ�Ϊ��13��0.4��1mol/L��
���������⿼��ѧ��ԭ��صĹ���ԭ������ԭ���Ϊ���忼���˷�Ӧ����ʽ���йؼ��㣬��ȷ�ҳ������ʼ�Ĺ�ϵ�ǽⱾ��Ĺؼ��������ۺ���ǿ���Ѷȴ�

��ϰ��ϵ�д�
�����Ŀ
 ����Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺
����Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺