题目内容
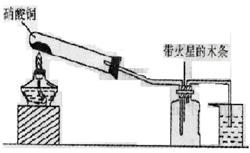
已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,反应的化学方程式为 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例) 。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为 。
(1)浓盐酸 ; MnO2;
(2) ;除去Cl2中的HCl气体;
;除去Cl2中的HCl气体;
(3)A ;有淡黄色沉淀生成 ; Na2S+Cl2 =2NaCl+ S↓ ;
(4)HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等
(5)Cl2 + 2OH— =Cl— + ClO—+ H2O
解析试题分析:(1)装置A用于Cl2的制取,把MnO2放在烧瓶中,把浓HCl放在分液漏斗中。(2)加热A装置,发生反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。
MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。
考点:考查Cl2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。

硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下: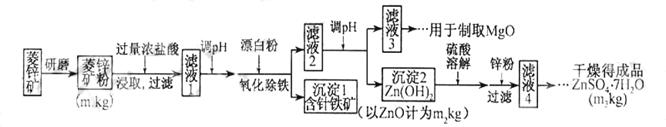
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH[来源 | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×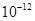 | — | 6.8×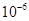 | 2.8×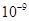 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉b.石灰乳c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
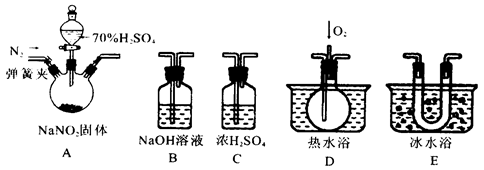
(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | | III |
| ② | 滴加少量棕红色的KI3溶液,振荡 | | II |
| ③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 | |
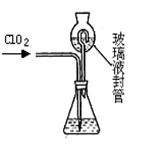
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 硫的质量确定: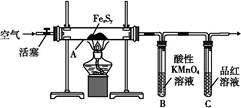
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.1 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
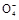 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S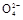 +4H+
+4H+②2Mn
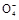 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O【实验Ⅱ】 铁的质量确定:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是 。
(2)滴定终点的判断方法是 。
(3)试管C中品红溶液的作用是 。
有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是 。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为 。
【问题探究】 滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4 溶液/mL | KMnO4 溶液/mL | 溶液褪 色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶 于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述数据,滴定过程中反应速率较快的一种可能原因是 。