题目内容
【题目】(1)已知:在298K、101kPa时,
①C(s,石墨)+O2(g) = CO2(g) △H1 = -400 kJ·mol-1;
②2H2(g)+O2(g) = 2H2O(l) △H2 = -570 kJ·mol-1;
③2C2H2(g)+5O2(g) = 4CO2(g)+ 2H2O(l) △H3 = -2600 kJ·mol-1;
写出298K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式 。以硫酸为电解质溶液,依据反应③设计一个燃料电池,写出其电极反应式 。
(2)工业合成氨的反应原理为 N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1某温度下,把10 mol N2与25mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为50%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,则该温度下该反应的平衡常数K= 。
2NH3(g) ΔH=-92.4 kJ·mol-1某温度下,把10 mol N2与25mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为50%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,则该温度下该反应的平衡常数K= 。
【答案】(1)C(s,石墨)+H2(g)=C2H2(g)△H=+215kJ·mol-1
正极:5O2+20H++20e-=10H2O
负极:2C2H2+8H2O-20e-=4CO2+20H+
(2)0.15,2mol-2·L2
【解析】
试题分析:(1)根据盖斯定律,①×2+②÷2-③÷2得C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式C(s,石墨)+H2(g) = C2H2(g) △H = +215 kJ·mol-1;乙炔发生氧化反应,通入乙炔的一极为负极,2C2H2+8H2O-20e-= 4CO2+ 20 H+;通入氧气的一极为正极,5O2 + 20 H+ +20e-=10H2O;(2)氮气的平衡转化率为50%,消耗氮气5 mol N2,消耗氢气15mol,![]() 0.15 mol·L-1·min-1;
0.15 mol·L-1·min-1;
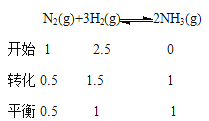
则该温度下该反应的平衡常数K=![]() mol-2·L2。
mol-2·L2。