题目内容
【题目】【化学—选修3:物质结构与性质】
2015年我国自主研制的C919大型客机正式下线,标志着我国成为世界上少数几个掌握研发制造大型客机能力的国家,同时意味着中国高端装备制造业发展到一个全新的高度。
(1)飞机的外壳通常采用镁、铝、钛合金材料,钛的价电子排布图为__________,第一电离能:镁 _________铝(填“大于”或“小于”)。
(2)Fe与CO能形成配合物羰基铁[Fe(CO)5],该分子中σ键与π键个数比为________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
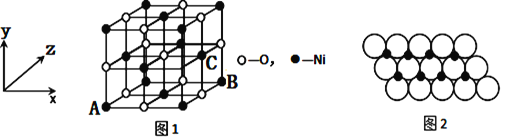
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
【答案】 ![]() 大于 1∶1 sp3 V形或折线形均可 > 离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高 (1,
大于 1∶1 sp3 V形或折线形均可 > 离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高 (1, ![]() ,
, ![]() )或(1,0.5,0.5)
)或(1,0.5,0.5) ![]() 或
或![]() 或
或![]()
【解析】(1).钛为22号元素,价电子排布为3d24s2,价电子排布图为![]() ,镁元素的3s能级为全满稳定状态,能量较低,镁的第一电离能大于铝的,故答案为:
,镁元素的3s能级为全满稳定状态,能量较低,镁的第一电离能大于铝的,故答案为: ![]() ;大于; (2) Fe与CO能形成配合物羰基铁[Fe(CO)5],每个CO中含有1个σ键和2个π键,所以该分子中σ键有4+4=8,π键有4个,所以二者比例为1:1,故答案为: 1∶1; (3). SCl2分子中硫原子杂化轨道数为(6+2)/2=4,采取sp3杂化方式,两队孤对电子对,所以该分子构型为V形或折线形,故答案为:sp3 ;V形或折线形均可; (4). 其中Mg2+和Ni2+的离子半径分别为66pm和69 pm,根据离子电荷相同时,离子半径越小,晶格能越大分析,MgO熔点大于NiO的熔点,故答案为: >;离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高; (5) NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),而C离子的x系坐标和Bx坐标相同,yz系坐标都在中点上,所以C离子坐标参数为(1,
;大于; (2) Fe与CO能形成配合物羰基铁[Fe(CO)5],每个CO中含有1个σ键和2个π键,所以该分子中σ键有4+4=8,π键有4个,所以二者比例为1:1,故答案为: 1∶1; (3). SCl2分子中硫原子杂化轨道数为(6+2)/2=4,采取sp3杂化方式,两队孤对电子对,所以该分子构型为V形或折线形,故答案为:sp3 ;V形或折线形均可; (4). 其中Mg2+和Ni2+的离子半径分别为66pm和69 pm,根据离子电荷相同时,离子半径越小,晶格能越大分析,MgO熔点大于NiO的熔点,故答案为: >;离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高; (5) NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),而C离子的x系坐标和Bx坐标相同,yz系坐标都在中点上,所以C离子坐标参数为(1, ![]() ,
, ![]() )或(1,0.5,0.5),故答案为(1,
)或(1,0.5,0.5),故答案为(1, ![]() ,
, ![]() )或(1,0.5,0.5) (6)根据图片可知,每个氧化镍所占的面积为
)或(1,0.5,0.5) (6)根据图片可知,每个氧化镍所占的面积为![]() ,则每平方米含有的氧化镍个数=
,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() ,所以每平方米含有的氧化镍质量=
,所以每平方米含有的氧化镍质量=![]() ×
×![]() =
=![]() ,故答案为:
,故答案为: ![]() 或
或![]() 或
或![]() 。
。

【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为_______反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____℃。该温度下,若向该容器中充入n(CO2)=1mol, n(H2)=1mol,4min末达到平衡,CO2的转化率为_______;H2的体积分数为________________。
(4)写出增大逆反应速率的措施:___________________;(至少写两种)