题目内容
为了证实木炭和浓H2SO4的反应产物,可用下列流程进行验证(箭头表示气体的流向).

回答下列问题:
(1)根据上述流程中什么现象证明产物是H2O、CO2、SO2:
(2)酸性KMnO4溶液的作用是

回答下列问题:
(1)根据上述流程中什么现象证明产物是H2O、CO2、SO2:
无水硫酸铜变蓝,证明有H2O
无水硫酸铜变蓝,证明有H2O
;品红试液I褪色,证明有SO2
品红试液I褪色,证明有SO2
;品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2
品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2
.(2)酸性KMnO4溶液的作用是
去除SO2
去除SO2
,能否用溴水代替酸性高锰酸钾溶液?能
能
.(填“能”或“不能”),请写出化学反应方程式Br2+SO2+2H2O═2HBr+H2SO4
Br2+SO2+2H2O═2HBr+H2SO4
(若回答不能,则此空不用答题)分析:(1)根据二氧化碳和二氧化硫的性质进行解答;
(2)高锰酸钾、溴水具有氧化性,二氧化硫具有还原性,据此即可解答.
(2)高锰酸钾、溴水具有氧化性,二氧化硫具有还原性,据此即可解答.
解答:解:(1)无水硫酸铜变蓝,证明有H2O,品红试液I褪色,证明有SO2,用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色,澄清的石灰水和二氧化碳反应变浑浊,证明有CO2,
故答案为:无水硫酸铜变蓝,证明有H2O;品红试液I褪色,证明有SO2;品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2;
(2)品红试液I褪色,证明有SO2,溴水具有氧化性,也可以氧化SO2,故答案为:去除SO2;能;Br2+SO2+2H2O═2HBr+H2SO4.
故答案为:无水硫酸铜变蓝,证明有H2O;品红试液I褪色,证明有SO2;品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2;
(2)品红试液I褪色,证明有SO2,溴水具有氧化性,也可以氧化SO2,故答案为:去除SO2;能;Br2+SO2+2H2O═2HBr+H2SO4.
点评:本题考查了浓硫酸的性质应用,关键是理解掌握二氧化硫的性质,难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
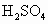 的反应产物,可用下列流程进行验证(如图所示;箭头表示气体的流向).
的反应产物,可用下列流程进行验证(如图所示;箭头表示气体的流向).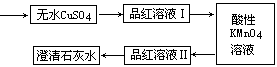
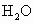 、
、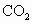 、
、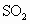 ?
?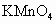 溶液的作用是________,能否用
溶液的作用是________,能否用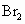 水代替
水代替

