题目内容
将一定质量的Mg、Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,加1mol/L的NaOH溶液得下图关系。



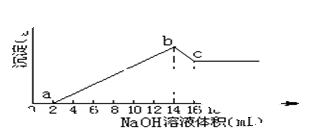
(1)求Mg, Al质量各是多少?
(2)求盐酸的物质的量浓度为多少mol/L?




(1)求Mg, Al质量各是多少?
(2)求盐酸的物质的量浓度为多少mol/L?
(1)(4分)3.6g、2.7g
(2)(3分)1.4mol/L
(2)(3分)1.4mol/L
试题分析:(1)由图像得,10mL溶液中铝镁离子全部深沉用去了0.014mol的NaOH,而随后Al(OH)3溶解用去了0.002mol的NaOH,由Al3++3OH- ~~Al(OH)3+OH-~~AlO2- 得n(Al3+)=0.002mol,则2n(Mg2+)=0.012-0.002×3=0.006,所以n(Mg2+)=0.003,则m(Mg)=24×0.006="0.072g" ,m( Al)=0.054g .所以原溶液中镁,铝的质量各为3.6g ,2.7g. (2)当NaOH滴至14ml时,镁铝全部沉淀,溶液中的溶质全部为NaCl,根据Cl 原子守恒,即得:n(HCl)=n(Cl-)=n(NaCl)=0.014mol,所以C(HCl)=0.014/0.01=1.4mol/L
点评:本题属于常规考题,本题关键在于理解图像的变化趋势,找到铝与氢氧化钠反应的特殊性。解此类题目时,要抓住起点和拐点,此题抓住最高点来计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。