题目内容
(18分)以硫 铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
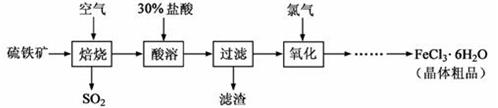
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: + Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
 铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: +
 Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
(1) 4FeS2+11O2 2Fe2O3+8SO2 ↑(2分)
2Fe2O3+8SO2 ↑(2分)
还原剂 既是氧化产物,又是还原产物
2SO2(g)+O2(g) 2SO3(g) SO3+H2O=H2SO4
2SO3(g) SO3+H2O=H2SO4
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+
(4) Cl2 +OH-=Cl-+ClO-+H2O H++OH-=H2O
SO2+2OH-=SO32- +H2O SO2+OH-=HSO3-
(5)在HCl的氛围中,加热浓缩,冷却结晶,过滤(4分)
 2Fe2O3+8SO2 ↑(2分)
2Fe2O3+8SO2 ↑(2分) 还原剂 既是氧化产物,又是还原产物
2SO2(g)+O2(g)
 2SO3(g) SO3+H2O=H2SO4
2SO3(g) SO3+H2O=H2SO4(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+
(4) Cl2 +OH-=Cl-+ClO-+H2O H++OH-=H2O
SO2+2OH-=SO32- +H2O SO2+OH-=HSO3-
(5)在HCl的氛围中,加热浓缩,冷却结晶,过滤(4分)
略

练习册系列答案
相关题目
 酸中,被氧化的HCl与未被氧化的HCl的质量比为 .
酸中,被氧化的HCl与未被氧化的HCl的质量比为 . 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( ) 的是
的是 +2NaOH =Na2SO3
+2NaOH =Na2SO3