题目内容
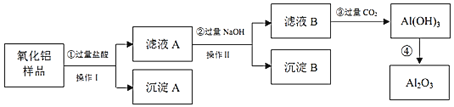
【题目】钴是国民经济建设和国防建设不可缺少的重要原料之一,从锂离子二次电池正极![]() 废料--铝钴膜中回收钴的工艺如图所示:
废料--铝钴膜中回收钴的工艺如图所示:

回答下列问题:
(1)写出工业上用![]() 制取铝的化学方程式______
制取铝的化学方程式______
(2)工艺图中加入氢氧化钠净化的目的是______
(3)为使钴浸出。需将![]() 的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
(4)锂可由电解制得,以石墨为阳极,低碳钢为阴极,电解液为熔融的LiCl和KCl的混合液,电解槽压为6.0-6.5V,这样可得到纯度为99%的锂。
①在电解液中加人KCl的原因______
②阴极产物与镁的性质相似,在常温下与氮气反应,请写出其与氮气反应的生成物与水的反应方程式______
③已知阴极产物在500℃与氢气能反应生成氢化物,请写出该氢化物的电子式______
(5)已知钴与铁的性质相似,请写出四氧化三钴与氢碘酸反应的离子方程式______
【答案】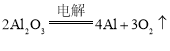 除去杂质离子Al3+
除去杂质离子Al3+ ![]() 增强电解液的导电性
增强电解液的导电性 ![]() Li+[:H]-
Li+[:H]- ![]()
【解析】
铝钴膜废料的成分为![]() 和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为
和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为![]() ;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀,通过加热得到氧化铝,再通过电解熔融氧化铝获得金属Al;将滤渣用双氧水、硫酸处理后生成
;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀,通过加热得到氧化铝,再通过电解熔融氧化铝获得金属Al;将滤渣用双氧水、硫酸处理后生成![]() 、
、![]() ,溶液中含有杂质铝离子,然后加入氢氧化钠溶液调节溶液pH,生成氢氧化铝沉淀从而除去铝离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到碳酸锂和金属Co。
,溶液中含有杂质铝离子,然后加入氢氧化钠溶液调节溶液pH,生成氢氧化铝沉淀从而除去铝离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到碳酸锂和金属Co。
(1)电解熔融氧化铝可以获得金属铝和氧气,反应的化学方程式为: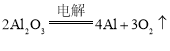 ,故答案为:
,故答案为: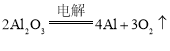 ;
;
(2)滤渣用硫酸和双氧水处理后Co元素全部留在滤液中,且滤液中含有杂质铝离子,用氢氧化钠溶液调节pH,可以将杂质铝离子除掉,故答案为:除去杂质离子Al3+;
(3)酸浸时反应物有硫酸、过氧化氢以及![]() ,生成物有
,生成物有![]() 和
和![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)①电解液中加入氯化钾后,可以大大提高电解液的导电性,增强电解效果,故答案为:增强电解液的导电性;
②电解熔融LiCl过程中,阴极得到的是金属Li,锂与氮气反应生成![]() ,氮化锂与水反应会生成氨气和氢氧化锂,反应的化学方程式为:
,氮化锂与水反应会生成氨气和氢氧化锂,反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
③电解熔融LiCl过程中,阴极得到的是金属Li,锂与氢气在一定条件下反应生成氢化锂,氢化锂为离子化合物,其电子式为:Li+[:H]-,故答案为:Li+[:H]-;
(5)已知钴与铁的性质相似,则四氧化三钴与四氧化三铁的化学性质相似,四氧化三铁与碘化氢反应的离子方程式为:![]() ,则四氧化三钴与氢碘酸反应的离子方程式:
,则四氧化三钴与氢碘酸反应的离子方程式:![]() ,故答案为:
,故答案为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案