题目内容
15.下列化合物中氯元素化合价是-1价或+1价的是.| A. | KClO3 | B. | CaCl2 | C. | NaClO | D. | Ca(ClO)2 |
分析 根据化合物中各元素化合价代数和是零,结合物质的化学式进行判断.
解答 解:A、氯元素的化合价-1价,是+5价,故A错误;
B、氯元素的化合价是-1价,故B正确;
C、氯元素的化合价是+1价,故C正确;
D、氯元素的化合价是+1价,故D正确;
故选BCD.
点评 本题考查学生化合价规则的使用知识,注意元素的化合价的判断是关键,较简单.

练习册系列答案
相关题目
5.在一个容积固定为2L的密闭容器中,发生反应aA(g)+bB(g)?pC(g)△H=?反应情况记录如表:
请仔细分析表中数据,回答下列问题:
(1)p=2,a=1,b=2(取最小整数)
(2)第2min到第4min内,A的平均反应速率v(A)=0.2 mol•L-1•min-1
(3)若从开始到第4min建立平衡时,反应放出的热量为234kJ,则该反应的△H=-195.
| 时间 | c(A)/(mol•L-1) | c(B)/(mol•L-1) | c(C)/(mol•L-1) |
| 0min | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
(1)p=2,a=1,b=2(取最小整数)
(2)第2min到第4min内,A的平均反应速率v(A)=0.2 mol•L-1•min-1
(3)若从开始到第4min建立平衡时,反应放出的热量为234kJ,则该反应的△H=-195.
6.一定温度下,在定容容器中发生反应:X(g)+2Y(g)?4Z(g).下列叙述中能说明该反应已达到平衡状态的是( )
| A. | 单位时间内消耗amolX,同时生产4amolZ | |
| B. | 容器内的氧气不再变化 | |
| C. | Z的生成速率与Y的生成速率比值为1:2 | |
| D. | 容器内气体的密度不发生变化 |
3. 某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为X+3Y?2Z;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol•(L•min)-1;
(3)若其它条件不变,只改变一个反应条件,将反应速率的变化填入表中空格里.
(填字母:A.增大 B.减小 C.不变)
 某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:(1)由图中所给数据进行分析,该反应的化学方程式为X+3Y?2Z;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol•(L•min)-1;
(3)若其它条件不变,只改变一个反应条件,将反应速率的变化填入表中空格里.
(填字母:A.增大 B.减小 C.不变)
| 改变条件 | 降低温度 | 增加X的量 | 使用催化剂 | 容器体积减半 |
| 速率变化 |
10.等体积的0.05mol/L的MgCl2溶液和0.04mol/L的AgNO3溶液混合,充分反应后,溶液中离子浓度最大的是( )
| A. | Mg2+ | B. | Cl- | C. | Ag+ | D. | NO3- |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Ca2+、Fe2+、NO3-、CO32- | |
| B. | $\frac{K}{c(OH^{-})}$=10-2mol/L的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(Fe3+)=0.1mol/L的溶液中:K+、SCN-、SO42-、Cl- | |
| D. | 由水电离的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14mol/L的溶液中:Na+、AlO2-、HCO3-、OH- |
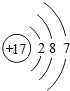 ,它和金属或氢化合时显负价,生成物溶于水后氯元素以无色-1价的阴离子存在,其电子层结构为
,它和金属或氢化合时显负价,生成物溶于水后氯元素以无色-1价的阴离子存在,其电子层结构为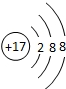 .
. 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.