题目内容
【题目】利用生产钛白的副产品绿矾(FeSO47H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:
FeCO3![]() FeO+CO2,
FeO+CO2,
C+CO2![]() 2CO,
2CO,
CO+FeO![]() Fe+CO2,
Fe+CO2,
(1)检验绿矾是否已有部分氧化的方法是 。
(2)证明沉淀已经洗涤干净的方法是 。
(3)干燥过程中少量FeCO3nH2O被氧化为FeOOH,反应方程式为: 。
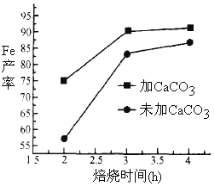
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,上图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 。
【答案】(1)取少量绿矾溶于水,滴加KSCN溶液,若溶液显红色,表明绿矾已有部分氧化。
(2)取少量最后一次洗涤滤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净。
(3)4FeCO3·nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O
(4)分解产生CO2与C反应生成还原剂CO。
【解析】
试题分析:(1)绿矾是FeSO4·7H2O,若变质,会被氧化成Fe3+,根据铁离子的检验方法,检验绿矾是否已有部分氧化的方法是取少量绿矾溶于水,滴加KSCN溶液,若溶液显红色,表明绿矾已有部分氧化。
(2)FeCO3nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀,如果沉淀已经洗涤干净,则其洗涤液中不含硫酸根离子,其检验方法是:取少量最后一次洗涤滤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净。
(3)FeCO3nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水,反应方程式为:4FeCO3·nH2O +O2 = 4FeOOH + 4CO2↑ + (4n-2)H2O。
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以CaCO3的另一作用为分解产生CO2与C反应生成还原剂CO。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案