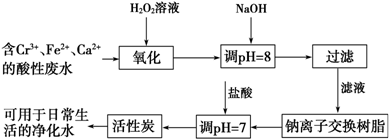
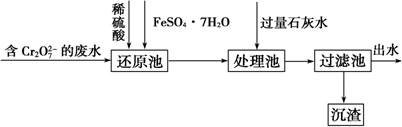
题目内容
3.下列物质:①8gCH4 ②标准状况下体积为28L的NH3 ③4℃时,10.8mL的水 ④含有6.02×1024个电子的HF气体(1)含有原子数由少到多的顺序是③④①②.
(2)含有化学键数目由少到多的顺序是④③①②.
分析 根据n=$\frac{m}{M}$计算甲烷物质的量;根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量;根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量;根据n=$\frac{N}{{N}_{A}}$计算电子物质的量,进而计算HF物质的量.
(1)结合分子式含有原子数目计算各物质含有原子总物质的量;
(2)甲烷分子中含有4个C-H键,氨气分子中含有3个N-H键,水分子中含有2个O-H键,HF分子中含有1个H-F,计算共价键物质的量进行比较.
解答 解:①8gCH4 的物质的量为$\frac{8g}{16g/mol}$=0.5mol,含有原子物质的量为0.5mol×5=2.5mol,含有共价键为0.5mol×4=2mol;
②标准状况下体积为28L的NH3 的物质的量为$\frac{28L}{22.4L/mol}$=1.25mol,含有原子物质的量为1.25mol×4=5mol,含有共价键为1.25mol×3=3.75mol;
③4℃时,10.8mL水的质量为10.8g,其物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,含有原子物质的量为0.6mol×3=1.8mol,含有共价键为0.6mol×2=1.2mol;
④6.02×1024个电子的物质的量为$\frac{6.02×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=10mol,则HF的物质的量为1mol,含有原子物质的量为1mol×2=2mol,含有共价键为1mol×1=1mol,
故含有原子数由少到多的顺序是:③④①②,
含有化学键数目由少到多的顺序是:④③①②,
故答案为:(1)③④①②;(2)④③①②.
点评 本题考查物质的量有关计算,熟练掌握有关计算公式和物质的结构是解题关键,难度不大.

| A. | $\frac{14m}{n-m}$ | B. | $\frac{14m}{m+2n}$ | C. | $\frac{14m}{2n-m}$ | D. | $\frac{2n-m}{14m}$ |

| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |