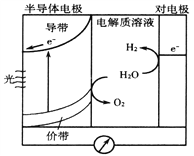
题目内容
【题目】I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。
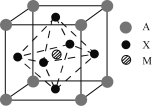
(1)吸光材料的化学式为___(用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____。
(3)溴原子基态核外价电子排布式为___。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___。
(5)CH3NH2中N原子的轨道杂化类型为__;1mol CH3NH3+中含σ键的数目为____。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____。
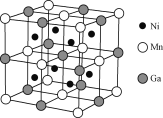
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___。每个Mn周围最近且等距离的Mn数目为___,每个Ga周围最近且等距离的Mn数目为____。
【答案】AMX3 H<C<Cl 4s24p5 CH3NH2与H2O形成分子间氢键 sp3 7mol或7×6.02×1023 第四周期VIII族 N2H4分子间可以形成氢键 ![]() Ni2MnGa 12 6
Ni2MnGa 12 6
【解析】
I (1) 该晶胞中A微粒个数=8×![]() =1、X微粒个数=6×
=1、X微粒个数=6×![]() =3、M微粒个数=1,其化学式为AMX3;
=3、M微粒个数=1,其化学式为AMX3;
(2)元素的非金属性越强,其电负性越大,非金属性CI>C>H,则电负性H<C<C1;
(3) Br原子核外有35个电子,根据构造原理书写该原子核外电子排布式为[Ar]3ds104s24p5;
(4)能和水形成氢键的溶质溶解性较大,CH3NH2与H2O形成分子间氢键,所以甲胺极易溶于水;
(5)N原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断N原子轨道杂化方式为sp3;该微粒中含有7个σ键,1 mol CH3NH3+中含σ键的数目为7 mol或7×6.02×1023 ;
II(1)Ni的原子序数为28,在周期表中的位置为第四周期VIII族;
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。N2H4分子间可以形成氢键,故配体N2H4的熔沸点比C2H6高得多;Ni2+提供空轨道,N2H4中N原子提供孤对电子,形成配位键, [Ni(N2H4)2]2+的结构可用示意图表示为![]() ;
;
(3) Ni原子处于小立方体体心,晶胞中Ni原子数目=8,Mn原子处于顶点与面心,晶胞中Mn原子数目=8×![]() +6×
+6×![]() =4,Ga处于晶胞体心与棱心,晶胞中Ga原子数目=1+12×
=4,Ga处于晶胞体心与棱心,晶胞中Ga原子数目=1+12×![]() =4,则晶胞中Ni、Mn、Ga原子数目之比=8: 4: 4=2: 1: 1,故晶体的化学式为: Ni2MnGa;
=4,则晶胞中Ni、Mn、Ga原子数目之比=8: 4: 4=2: 1: 1,故晶体的化学式为: Ni2MnGa;
根据晶胞的结构可知,每个Mn周围最近且等距离的Mn数目为12,每个Ga周围最近且等距离的Mn数目为6。