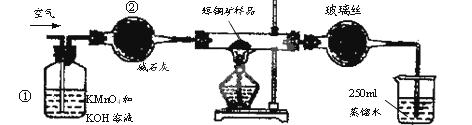
题目内容
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)  Ca2+(aq)+20H一(aq),下列说法正确的是( )
Ca2+(aq)+20H一(aq),下列说法正确的是( )
 Ca2+(aq)+20H一(aq),下列说法正确的是( )
Ca2+(aq)+20H一(aq),下列说法正确的是( )| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体 质量不变 |
C
试题分析:A、恒温下向溶液中加CaO,溶液仍然为饱和的caoh2溶液, pH不变,错误;B、给溶液加热,温度升高,Ca(OH)2的溶解度减小,溶液的pH减小,错误;C、向溶液中加入Na2CO3溶液,Na2CO3与Ca(OH)2反应生成CaCO3沉淀,所以固体质量增加,正确;D、向溶液中加入少量NaOH固体,增加了OH?浓度,平衡向左移动,Ca(OH)2固体质量减小,错误。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
 Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )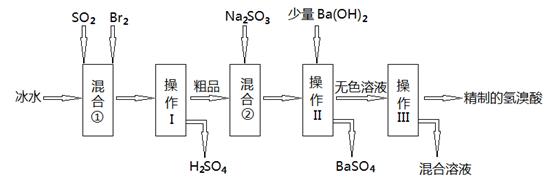
 AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816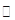 SO2 +2Cu。
SO2 +2Cu。