题目内容
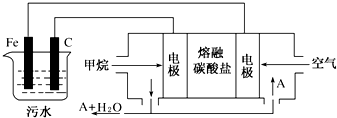
8.工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.某科研小组用此法处理污水,设计装置示意图,如图所示.(1)实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣.此时,应向污水中加入适量的C.
A.BaSO4 B.CH3CH2OH C.Na2SO4 D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
①Fe-2e-=Fe2+;②2H2O-4e-=4H++O2↑.
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是4Fe2++10H2O+O2═4Fe(OH)3↓+8H+.
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.已知负极的电极反应是CH4+4CO2-3-8e-═5CO2+2H2O.则正极的电极反应是O2+2CO2+4e-=2CO32-.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
分析 (1)从所加入物质能增大溶液离子浓度,并能保持污水的pH在5.0~6.0之间考虑;
(2)根据电极材料和离子的放电顺序考虑;
(3)二价铁离子具有还原性,能被氧气氧化到正三价,而溶液呈酸性,所以反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳.
解答 解:(1)为了增强溶液的导电性,因此可选用易溶性强电解质溶液,排除A和B,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加NaOH,BaSO4不溶,故答案为:C;
(2)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:Fe-2e-=Fe2+;2H2O-4e-=4H++O2↑;
(3)二价铁离子具有还原性,能被氧气氧化到正三价,而溶液呈酸性,所以反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以正极反应为:O2+2CO2+4e-=2CO32-;负极反应是CH4失电子,该电池的电解质环境是熔融碳酸盐,所以负极反应为:CH4+4CO32--8e-=5CO2+2H2O;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
故答案为:O2+2CO2+4e-=2CO32-;CO2.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.

 寒假学与练系列答案
寒假学与练系列答案| A. | 甲烷、乙烯、乙炔 | B. | 苯、汽油、乙酸乙酯 | ||
| C. | 甲醇、乙醇、苯 | D. | 己烯、苯、四氯化碳 |
| A. | A2B | B. | AB2 | C. | AB3 | D. | A2B5 |
| A. | 乙醇 | B. | 乙酸 | C. | 乙醛 | D. | 乙酸乙酯 |
| A. | 纯净的苯酚是粉红色的晶体 | |
| B. | 有特殊的气味 | |
| C. | 易溶于乙醇、乙醚等有机溶剂,不易溶于冷水 | |
| D. | 苯酚有毒,沾在皮肤上,可用浓NaOH溶液洗涤 |
| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | HOCH2CH2CH2COOH | D. | CH3CH2CH(OH)COOH |

| A. | 铜是负极,铜片上有气泡产生 | |
| B. | 铜片是正极,该电极周围溶液pH不变 | |
| C. | 电子流从锌片经导线流向铜片 | |
| D. | 氢离子在锌片表面被还原 |
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
