题目内容
下列叙述的两个量,一定相等的是( )
A.质量相等的金刚石和C60中的碳原子数目
B.0.1 mol/L NaCl溶液与0.05 mol/L Na2CO3溶液中所含Na+的数目
C.标准状况下等体积的SO2和SO3的分子数目
D.等体积pH都为3的稀盐酸与FeCl3溶液中,由水电离产生的H+数目
A
【解析】金刚石和C60均只由碳原子组成,质量相等,则碳原子数目相等,A项正确;B项中未给出溶液的体积,溶液中Na+数目多少无法比较,错误;标准状况下SO2为气体而SO3为固体,C项错误;稀盐酸中水的电离受到抑制而FeCl3溶液中水的电离受到促进,故后者水电离出的H+浓度大于前者,D项错误

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
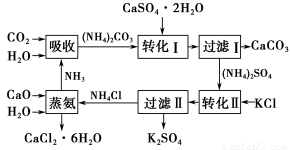
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:______________________________________________________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:_______________________________________________________________。
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
温度/℃ | 0 | 20 | 60 |
K2SO4溶解的量/g | 7.4 | 11.1 | 18.2 |
60 ℃时K2SO4的饱和溶液591 g冷却到0 ℃,可析出K2SO4晶体________g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________________________________________________。
