题目内容
【题目】已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=Q1
②H2(g)+![]() O2(g)===H2O(g) ΔH2=Q2
O2(g)===H2O(g) ΔH2=Q2
③H2(g)+![]() O2(g)===H2O(l) ΔH3=Q3
O2(g)===H2O(l) ΔH3=Q3
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
【答案】D
【解析】标准状况下,11.2 L混合气体中,n(CH4)=![]() ×0.5 mol=0.4 mol,则n(H2)=0.1 mol,由于完全燃烧恢复到常温时,水为液体,因此H2燃烧放出的热量应按③进行计算,结果为0.4Q1+0.1Q3。
×0.5 mol=0.4 mol,则n(H2)=0.1 mol,由于完全燃烧恢复到常温时,水为液体,因此H2燃烧放出的热量应按③进行计算,结果为0.4Q1+0.1Q3。

【题目】碳酸钴常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。
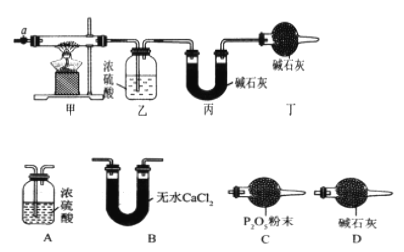
(1)请完成下列实验步骤:
①称取 3. 65 g 样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中_______ (填实验现象),停止加热;
④打开活塞 a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是___________________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在_______(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为______________。