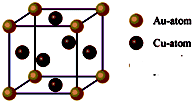
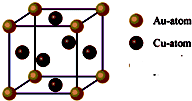
题目内容
下列分子或离子之间互为等电子体的是
- A.CCl4 和 PO43-
- B.NH3 和 NH4+
- C.NO2 和 CS2
- D.CO2 和 SO2
A
价电子数与原子总数分别都相等的是等电子体,所以选项A正确;B中原子数不相等,C中价电子数不相等,D中价电子数也是不相等的,所以正确的答案选A。
价电子数与原子总数分别都相等的是等电子体,所以选项A正确;B中原子数不相等,C中价电子数不相等,D中价电子数也是不相等的,所以正确的答案选A。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目

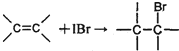
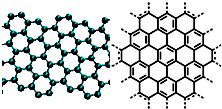
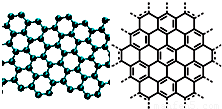
 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右: