题目内容
【题目】(Ti)及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域,工业上常以金红石(主要成分是TiO2)、焦炭、氯气、金属镁为原料生产金属钛,其流程如下:

(1)过程Ⅰ中,可燃性气体X是______。
(2)过程Ⅱ中,发生反应的化学方程式是______;稀有气体的作用是______。
【答案】CO TiCl4+2Mg![]() 2MgCl2+Ti 防止高温下Mg、Ti与空气中的O2 或N2、CO2反应或防止金属Mg、Ti被氧化
2MgCl2+Ti 防止高温下Mg、Ti与空气中的O2 或N2、CO2反应或防止金属Mg、Ti被氧化
【解析】
金红石TiO2与C、Cl2在高温下反应产生TiCl4、CO;TiCl4与Mg在稀有气体存在条件下 ,加热发生反应产生Ti、MgCl2。
(1)在过程I中,金红石TiO2与C、Cl2在高温下反应产生TiCl4、CO,反应方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO,所以反应产生的可燃性气体为CO;
TiCl4+2CO,所以反应产生的可燃性气体为CO;
(2)在过程Ⅱ中,TiCl4与Mg在稀有气体存在条件下,加热,发生金属的置换反应产生Ti、MgCl2,发生反应的化学方程式是TiCl4+2Mg![]() 2MgCl2+Ti;稀有气体的作用是作保护气,防止高温下Mg、Ti与空气中的O2 或N2、CO2反应或防止金属Mg、Ti被氧化。
2MgCl2+Ti;稀有气体的作用是作保护气,防止高温下Mg、Ti与空气中的O2 或N2、CO2反应或防止金属Mg、Ti被氧化。

【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO + H2O2= Ca(HCOO)2+ 2H2O + H2↑实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)反应温度最好控制_______________(A.60℃左右 B. 200左右 C. 400℃左右),原因是_____________。
(2)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 ____________________________。
(3)实验时需强力搅拌45min,其目的是_________________。
(4)结束后需调节溶液呈碱性,其目的是__________________________。
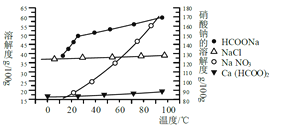
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 1 | 3. 2 |
Al3+ | 3. 0 | 5. 0 |
Fe2+ | 5. 8 | 8. 8 |
请补充完整由碳酸钙制备甲酸钙晶体的实验方案:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用,用__________溶解碳酸钙样品,调整溶液pH为5,过滤后,将滤液与甲酸钠溶液混合,调整溶液为碱性;充分搅拌,所得溶液经__________、___________洗涤干燥得甲酸钙晶体。(提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水)
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=_____________。
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
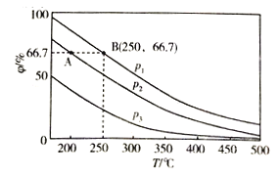
①其中,p1、p2和p3由大到小的顺序是________,其原因是__________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)____vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=______________(保留一位小数)。
(3)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
①混合气体的压强不变 ④混合气体的平均相对分子质量不变
②混合气体的密度不变 ⑤NH3的体积分数不变 ③混合气体的总物质的量不变