题目内容
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A.-44.2kJ·mol-1 | B.+44.2kJ·mlo-1 | C.-330kJ·mol-1 | D.+330kJ·mlo-1 |
A
试题分析:由题给燃烧热可得:
H2(g)+0.5O2(g)=H2O(l) △H=-285.8kJ·mol-1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=-1411.0kJ·mol-1
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
由盖斯定律得C2H4(g)+H2O(l)=C2H5OH(l) △H=-1411.0kJ·mol-1-1366.8kJ·mol-1=-44.2kJ·mol-1
点评:燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此先写出三种物质燃烧的热化学方程式,再根据盖斯定律得出答案。

练习册系列答案
相关题目
 Al(OH)3(aq)
Al(OH)3(aq) CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。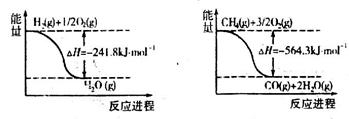
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为  ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1