题目内容
18.在一密闭容器中进行反应 X2(g)+3Y2(g)?2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡后,各物质的浓度有可能是( )| A. | c(X2)=0.2 mol/L | B. | c(Y2)=0.1 mol/L | C. | c(Z2)=0.4 mol/L | D. | c(Y2)=0.6 mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z2(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z2(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0<c(Y2)<0.6,0<c(Z2)<0.4,
故B正确、ACD错误;
故选:B.
点评 本题考查化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.

练习册系列答案
相关题目
8.我国古代的各种技术中,其工作原理不涉及化学反应的是( )
| A. | 使用火药 | B. | 用粮食酿酒 | C. | 用纺线车纺线 | D. | 铁的冶炼 |
9.下列各组粒子在指定溶液中一定能大量共存的一组是( )
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:NH4+、CH3COO-、SO42-、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
6.下列叙述中,正确的是( )
| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 含不同碳原子数的烷烃一定互为同系物 | |
| C. | 结构对称的烷烃,其一氯取代产物必定只有一种 | |
| D. | 分子通式相同且组成上相差一个或几个CH2原子团的物质互为同系物 |
13.向50mL 18mol•L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量( )
| A. | 小于0.45 mol | B. | 等于0.45 mol | ||
| C. | 在0.45 mol和0.90 mol之间 | D. | 大于0.90 mol |
3.下列物质的用途跟其化学性质相关的是( )
| A. | 干冰用于人工降雨 | B. | 铁粉用于食品保存 | ||
| C. | 稀有气体用来制作电光源 | D. | 铜用作电线 |
10.下列相关事实用微观粒子的知识解释错误的是( )
| 选项 | 事 实 | 解 释 |
| A | 墙内开花墙外可嗅到花香 | 分子不断运动 |
| B | 酒精溶液是混合物 | 由不同种分子构成 |
| C | 水结冰后体积变大 | 水分子体积变大 |
| D | 氢氧化钠溶液能导电 | 溶液中存在自由移动的Na+和OH- |
| A. | A | B. | B | C. | C | D. | D |
7.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式: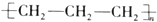 | B. | 四氯化碳分子的电子式: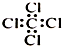 | ||
| C. | 2-乙基-1,3-丁二烯分子的键线式: | D. | 丙烷分子的比例模型: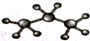 |
8.日常所用干电池的电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质).根据上述判断,下列结论正确的是( )
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |