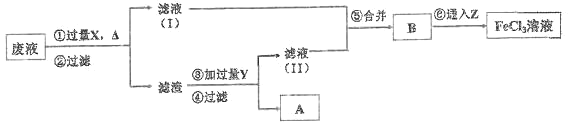
题目内容
【题目】氮的单质及其化合物性质多样,用途广泛。
完成下列填空。
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2;
2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间内的CO浓度如下表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c (CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
该反应的平衡常数表达式为________;温度升高,K值________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_______________。
(2)工业合成氨的反应温度选择500℃左右的原因是_________________。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___________。
a.N2、H2、NH3的浓度之比为1∶3∶2
b.容器内的压强保持不变
c. N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度有大到小的顺序是____________;在通入NH3的过程中溶液的导电能力________(选填“变大”、“变小”、“几乎不变”)。
【答案】 ![]() 减小 1.875×10-4mol/(L·s) 降低反应体系的温度或缩小容器的体积(合理即可) 该温度下催化剂的活性最大 bc c(Cl-)>c(NH4+)>c(H+)>c(OH-) 几乎不变
减小 1.875×10-4mol/(L·s) 降低反应体系的温度或缩小容器的体积(合理即可) 该温度下催化剂的活性最大 bc c(Cl-)>c(NH4+)>c(H+)>c(OH-) 几乎不变
【解析】(1)反应2NO+2CO![]() 2CO2+N2+Q(Q>0)的平衡常数表达式为
2CO2+N2+Q(Q>0)的平衡常数表达式为![]() ;该反应为放热反应,温度升高,平衡逆向移动,则K值减小;
;该反应为放热反应,温度升高,平衡逆向移动,则K值减小;
前2s内的平均反应速率v(N2)= ![]() v(CO)=
v(CO)= ![]() ×
×![]() = 1.875×10-4mol/(L·s);若上述反应在密闭容器中发生,降低反应体系的温度或缩小容器的体积,均可使平衡正向移动,提高NO转化率;
= 1.875×10-4mol/(L·s);若上述反应在密闭容器中发生,降低反应体系的温度或缩小容器的体积,均可使平衡正向移动,提高NO转化率;
(2)合成氨是放热反应,反应温度选择500℃左右的原因是该温度下催化剂的活性最大;
(3)a.N2、H2、NH3的浓度之比为1∶3∶2,此时不一定为平衡状态,故a错误;b.容器内气体总物质的量随反应的进行不断改变,当压强保持不变时,混合气体总物质不变,此时是平衡状态,故b正确;c. N2、H2、NH3的浓度不再发生变化,此时是平衡状态,故c正确;d.可逆反应达到平衡时是动态平衡,速率不为0,故d错误;答案为bc;
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液为NH4Cl,因NH4+水解溶液显酸性,则溶液中离子浓度有大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液中离子的总浓度保持不变,则溶液的导电能力几乎不变。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案