题目内容
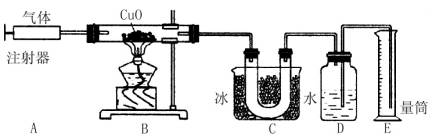
下图是用于测定含两种元素的某种气体x的化学式的实验装置图。
实验过程如下:在120℃;时,将装置A中的x气体缓缓通过已排尽空气并装有氧化铜的装置B,反应后在装置C中收集到水,装置D中收集到氮气。
装置B中黑色粉末变为红色光亮的粉末,并测得x反应了240mL,氧化铜质量减少了0.32g。
(1)240mL气体x完全反应后,装置E中收集到水240mL,测得1mol x气体的体积是24000 mL,则x的摩尔质量为________;x的化学式是________;(气体体积均换算成相同状况下的体积);
(2)B中发生化学反应的方程式是________(假设x在该条件下不分解)。
答案:
解析:
提示:
解析:
| (1)32 g/mol;X为N2H4
(2)
|
提示:
| 根据质量守恒推断x的摩尔质量,已知x是含有N的有还原性气体,推测其应该是肼。
|

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目

 +2H2O
+2H2O
 2O3)。
2O3)。