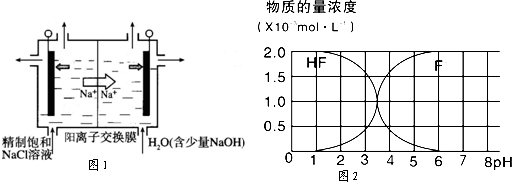
��Ŀ����
��8�֣��������ȣ�ClO2����һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ����������Cl2���á�
����ClO2���Ʊ������У������������Ʊ�������
����һ��2NaClO3��4HCl=2ClO2����Cl2����2NaCl��2H2O
��������2NaClO3��H2O2��H2SO4=2ClO2����Na2SO4��O2�� ��2H2O
��2H2O
�÷������Ʊ���ClO2���ʺ���������ˮ����������Ҫԭ���� ��
����ClO2������������ˮ��pH 5.5��6.5��������һ���������岻��������������ӣ�ClO2-����
����ˮ�е�ClO2��ClO2-���������������������вⶨ��ClO2��I-��ԭΪClO2-��Cl-��ת��������ҺpH�Ĺ�ϵ����ͼ��ʾ����pH��2 .0ʱ��ClO2-Ҳ�ܱ�I-��ȫ��ԭΪCl-����Ӧ���ɵ�I2�ñ�Na2S2O3��Һ�ζ���2Na2S2O3+ I2= Na2S4O6 + 2NaI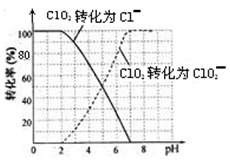
����д��pH��2 .0ʱClO2--��I-��Ӧ�����ӷ���ʽ ��
���������Ӧ��ʵ�� ���裺
���裺
����1��ȷ��ȡV mLˮ�����뵽��ƿ�С�
����2������ˮ����pHΪ7.0��8.0��
����3������������KI���塣
����4����������������Һ����c mol��L��1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV1mL��
����5�� ��
����6������c mol��L-1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2 mL��
�۸��������������ݣ���ø�����ˮ��ClO2-��Ũ��Ϊ  mol��L��1���ú���ĸ�Ĵ���ʽ��ʾ����
mol��L��1���ú���ĸ�Ĵ���ʽ��ʾ����
��8�֣��ŷ��� ���Ʊ���ClO2�в���Cl2��2�֣�
���Ʊ���ClO2�в���Cl2��2�֣�
�Ƣ�ClO2-+4H++4I-=Cl-+2I2+2H2O��2�֣�
�ڵ�����Һ��pH��2.0��2�֣� ��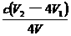 ��2�֣�
��2�֣�
����

 С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д� �������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������
�������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������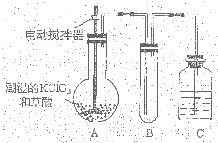 �������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺
�������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺