题目内容
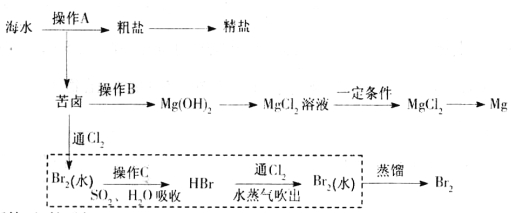
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
回答下列问题:
(1)操作A是_______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_____________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_____________。写出溴水中通入SO2时反应的离子方程式____________
(4)上图中虚线框内流程也可用![]() Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整:
![]()
(5)已知苦卤的主要成分如下:

理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。
【答案】(1)蒸发结晶(过滤)b(1分)
(2)c(1分)
(3)富集Br2 Br2+SO2+2H2O=4H++SO42-+2Br-
(4)3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2
(5)69.6
【解析】
试题分析:(1)海水得到粗盐的操作是蒸发结晶、过滤。盐水的浓度越大密度越大,要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是测定溶液密度;(2)苦卤获得氢氧化镁固体,需加入碱溶液,氢氧化钠价格高、石灰水的浓度小,最合适的是石灰乳;(3)上图中虚线框内是提取溴,上图中虚线框内流程的主要作用是富集Br2;溴水中通入SO2时反应的离子方程式Br2+SO2+2H2O=4H++SO42-+2Br- ,故A错误;(4)Br2与Na2CO3反应的化学方程式3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(5)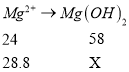 解得X=69.6g。
解得X=69.6g。