题目内容
10.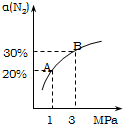 某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
分析 A、可逆反应反应物不能完全转化,结合热化学方程式的含义解答;
B、平衡常数只受温度影响,与压强无关;
C、增大压强平衡向体积减小的方向移动;
D、保持压强不变,通入惰性气体,体积变大,平衡常数只受温度的影响.
解答 解:A、热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示1mol氮气(g)与3mol氢气(g)反应生成2mol氨气(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故A错误;
B、平衡常数只受温度影响,与压强无关,增大压强平衡常数不变,故平衡常数K(A)=K(B),故B错误;
C、增大压强平衡向体积减小的方向移动,即向正反应移动,H2的转化率提高,故C正确;
D、保持压强不变,通入惰性气体,体积变大,各组分的分压减小,平衡逆向移动,但是温度不变,所以K不变,故D错误;
故选C.
点评 本题考查化学平衡图象、反应热计算、影响化学平衡与化学反应速率的因素等,难度中等,注意A中热化学方程式的意义.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列溶液中导电能力最强的是( )
| A. | 150mL0.2mol/L氢氧化钠溶液 | B. | 100mL0.3mol/L醋酸溶液 | ||
| C. | 200mL0.2mol/L硫酸溶液 | D. | 150mL0.2mol/L盐酸溶液 |
1.向含有1mol明矾的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法不正确的是( )
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
18.有关金属腐蚀的下述说法,不恰当的是( )
| A. | 一般来说,金属越活泼,越易发生腐蚀 | |
| B. | 金属发生腐蚀时表现了明显的氧化性 | |
| C. | 气温越高,金属越易腐蚀 | |
| D. | 金属腐蚀通常分化学腐蚀和电化学腐蚀两类 |
5.下列物质不能和水反应的是( )
| A. | NH3 | B. | Cu | C. | CaO | D. | SiO2 |
15.一定条件下,电解较稀浓度的硫酸,H2O2仅为还原产物,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2$\frac{\underline{\;电解\;}}{\;}$O3+3H2O2.下列有关说法正确的是( )
| A. | 电解池的阳极生成双氧水,阴极生成臭氧 | |
| B. | 电解池中硫酸溶液的pH保持不变 | |
| C. | 产生臭氧的电极反应式为3H2O-6e-=O3+6H+ | |
| D. | 产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+ |
19.碱金属的阳离子( )
| A. | 是强还原剂 | B. | 只有氧化性 | ||
| C. | 易被氧化 | D. | 其火焰都能呈现不同颜色 |
2.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀.
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)
 ,过氧化氢
,过氧化氢