题目内容
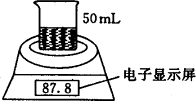
某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如下图所示: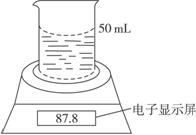
实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol·L-1NaOH溶液的烧杯中,试完成下列问题:
(1)合金表面最先产生气泡的位置是_____________(填“切口断面”或“非切口断面”),反应的离子方程式为:________________________________________________________。
(2)合金表面会形成原电池,其负极的电极反应式为:______________________________。
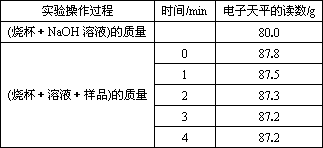
(3)不同时间电子天平的读数如下表所示:
实验操作过程 | 时间/min | 电子天平的读数/g |
烧杯+NaOH溶液 |
| 80.0 |
烧杯+溶液+样品 | 0 | 87.8 |
1 | 87.5 | |
2 | 87.3 | |
3 | 87.2 | |
4 | 87.2 |
则合金中铁的质量分数为(保留三位有效数字,下同)。
(4)上述50 mL NaOH溶液中最多可加入的铁铝合金样品质量为___________。
(1)切口断面 2Al+2OH-+2H2O====2![]() +3H2↑
+3H2↑
(2)Al-3e-+4OH-====![]() +2H2O (3)30.8% (4)9.75 g
+2H2O (3)30.8% (4)9.75 g
解析:(1)切口断面处NaOH溶液直接与Al反应,非切口断面处NaOH溶液先溶解表面的氧化膜后,才能与Al反应产生气体。
(2)Al失电子作负极,电极反应不能写成Al-3e-====Al3+,在强碱性溶液中最终应生成![]() ,应写成Al-3e-+4OH-====
,应写成Al-3e-+4OH-====![]() +2H2O。
+2H2O。
(3) 2Al — 3H2
2 mol 6 g
n(Al) 87.8 g-87.2 g=0.6 g
m(Al)=n(Al)×27g·mol-1=0.2 mol×27 g·mol-1=5.4 g
m(Fe)=87.8 g-80.0 g-5.4 g=2.4 g
Fe%=![]() ×100%=30.8%
×100%=30.8%
设需铝铁合金样品质量为x g,
(4)Al — NaOH
1 mol 1 mol
![]() 0.05 L×5.0 mol·L-1
0.05 L×5.0 mol·L-1
解得x=9.75 g


实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol·L-1 NaOH溶液的烧杯中。试完成下列问题:
(1)合金表面最先产生气泡的位置是___________ (填“切口断面”或“非切口断面”),反应的离子方程式为:__________________________________。
(2)合金表面会形成原电池,其负极的电极反应式为:__________________________________。
(3)不同时间电子天平的读数如下表所示:
实验操作过程 | 时间/min | 电子天平的读数/g |
烧杯+NaOH溶液 |
| 80.0 |
烧杯+溶液+样品 | 0 | 87.8 |
1 | 87.5 | |
2 | 87.3 | |
3 | 87.2 | |
4 | 87.2 |
则合金中铁的质量分数为____________(保留三位有效数字,下同)。
(4)上述50 mL NaOH溶液中最多可加入的铁铝合金样品质量为___________。
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.