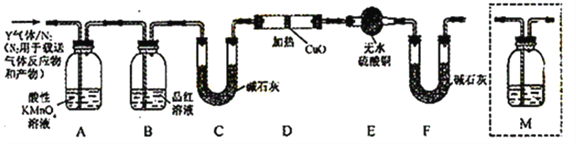
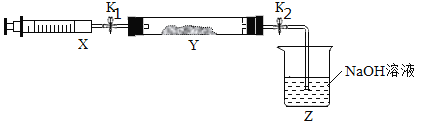
题目内容
【题目】25 ℃时,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): ;
(2)混合溶液中由水电离出的c(H+) (填 “<”“>”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH (填“<”“>”或“=”)7;
(4)将相同温度下相同浓度的五种溶液:①(NH4)2CO3 ②NH3·H2O ③(NH4)2SO4 ④NH4Cl ⑤CH3COONH4;按c(NH4+)由大到小的顺序排列 (填序号)。
【答案】(1)A-+H2O![]() HA+OH-(2)>(3)>(4)③>①>④>⑤>②
HA+OH-(2)>(3)>(4)③>①>④>⑤>②
【解析】
试题分析:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2OHA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1molL-1NaOH溶液中由水电离出的c(H+);
(3)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;
(4))①③④⑤相比,由于①⑤中NH4+水解得到促进,水解程度大于③④,且①>⑤中c(NH4+);③中(NH4)2SO4物质的量浓度与④相比,当二者浓度相等时,③中c(NH4+)接近④的2倍,NH3H2O,溶液中c(NH4+)小于铵盐的c(NH4+),应最小,由于水解程度一般较小,则①>④,按c(NH4+)由大到小的顺序排列为③①④⑤②。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸在热水中 | 红棕色变深 | 反应2NO2 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无 色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D