题目内容
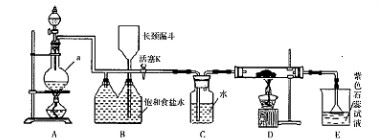
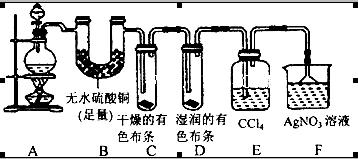
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水

(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
(20分)
(1)D(2分)
(2)4H++2Cl-+MnO2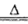 2H2O + Cl2↑+Mn2+;(3分)
2H2O + Cl2↑+Mn2+;(3分)
(3)随着反应的进行,盐酸浓度变稀将不再反应(3分,其他合理答案也给分)
(4)①证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;(3分)
②氯气无漂白性,次氯酸有漂白性(3分)
③吸收氯气(2分)
(5)E,F;(2分) AC(2分)
(1)D(2分)
(2)4H++2Cl-+MnO2
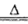 2H2O + Cl2↑+Mn2+;(3分)
2H2O + Cl2↑+Mn2+;(3分)(3)随着反应的进行,盐酸浓度变稀将不再反应(3分,其他合理答案也给分)
(4)①证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;(3分)
②氯气无漂白性,次氯酸有漂白性(3分)
③吸收氯气(2分)
(5)E,F;(2分) AC(2分)
试题分析:(1)制取氯气的方法由多种,但共同点有1个,都是浓盐酸作还原剂,所以合适的氧化剂与浓盐酸反应可以制取氯气,题目所给方法都可以,答案选D;
(2)实验室制取氯气采用MnO2和浓盐酸混合共热的方法,离子方程式为4H++2Cl-+MnO2
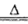 2H2O + Cl2↑+Mn2+;
2H2O + Cl2↑+Mn2+;(3)二氧化锰与稀盐酸不反应,所以随着反应的进行,盐酸浓度变稀,反应停止,制得Cl2的体积(标况下)总是小于1.12L;
(4)①用无水硫酸铜来检验是否有水产生,若有,则固体颜色由白色变为蓝色,后面的实验要求氯气使干燥的,所以装置B同时还可以吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;
②干燥的有色布条不褪色说明氯气不具有漂白性,湿润的有色布条褪色,说明氯气与水反应产生的次氯酸具有漂白性;
③氯气在水中的溶解度不大,但在有机溶剂中的溶解度较大,所以装置E的作用是吸收多余的氯气;
(5)装置E吸收氯气,但不能证明氯气是否被吸收干净,所以在E、F间应加一个装置,用来检验氯气是否除尽,从而判断通入AgNO3溶液中的气体是否只有一种;检验氯气是否除尽的试剂可以是湿润的淀粉KI试纸,若试纸变蓝,说明氯气未除尽;还可以是湿润的红色布条,若布条褪色,说明氯气未除尽,反之则除尽,答案选AC。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目