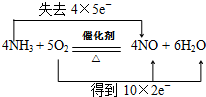
题目内容
3.取部分氧化的Fe-Cu合金样品(含Fe2O3、CuO)共5.76g,经如图处理.下列说法正确的是( )
| A. | 未氧化前合金的质量为5.44g | B. | V=448,它是H2和SO2的混合气体 | ||
| C. | 样品中CuO的质量为4.0g | D. | 滤液A中的阳离子为Fe2+、Fe3+、H+ |
分析 氧化性:Fe3+>Cu2+>H+,铁离子优先反应,其次是氢原子与铁反应,由于滤液中不含铜离子,且有气体氢气生成,则滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol;滤液A中不含铁离子,则最后灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,据此进行解答.
解答 解:A.滤液A中含有亚铁离子和氢离子,加入足量氢氧化钠溶液后,过滤,最后灼烧得到的固体为氧化铁,3.2g氧化铁的物质的量为0.02mol,含有铁元素的物质的量为0.02mol×2=0.04mol,样品中所有铁元素都生成了氧化铁,所以样品中Fe元素的质量为:56g/mol×0.04mol=2.24g,滤渣3.2g为金属铜,所以未氧化前合金的质量为5.44g,故A正确;
B.金属与稀硫酸反应只生成氢气,所以没有SO2生成,故B错误;
C.由于生成了氢气、滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故C错误;
D.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,所以滤液中一定不存在Fe3+,故D错误;
故选A.
点评 本题考查了铁、铜单质及其氧化物的性质,题目难度中等,注意掌握铁、铜的单质及其化合物性质,明确离子的氧化性强弱是解题关键,试题培养了学生的分析、理解能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 标准状况下,体积相同的两种气体的分子数一定相同 | |
| C. | 标准状况下,22.4L甲醇中含有的氧原子数目为1.0NA | |
| D. | 1L0.1mol•L-1的Fe2(SO4)3溶液中,Fe3+的数目为0.2NA |
14.下列说法错误的是( )
| A. | 青霉素有青霉素F、G、X、K、V | |
| B. | 因碘酒使蛋白质变性,故常用于外用消毒 | |
| C. | 在奶粉中添加三聚氰胺来提高蛋白质的含量 | |
| D. | 氨基酸是至少含有一个氨基和一个羧基的化合物 |
18.下列说法正确的是( )
| A. | 物质的量是七个基本物理量之一,符号为mol | |
| B. | 摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量 | |
| C. | 标准状况下,气体的摩尔体积为22.4L | |
| D. | 11.7克氯化钠溶于1000毫升水中,所得溶质的物质的量浓度为0.2mol•L-1 |
15.将5.21g纯铁粉溶于适量稀H2SO4中,加热条件下,用2.53g KNO3氧化Fe2+,充分反应后还需0.009mol Cl2才能完全氧化Fe2+,则KNO3的还原产物氮元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
12.将4gNaOH固体溶于水配成50mL溶液,取出其中5mL,则这5mLNaOH溶液的物质的量浓度为( )
| A. | 2mol/L | B. | 1mol/L | C. | 0.1mol/L | D. | 0.05mol/L |
13.下列说法正确的是( )
| A. | 分子式为H2O和D2O的性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能. |