题目内容
11.用图所示装置,加热铂丝一段时间后,通入NH3和O2,写出该装置硬质玻璃管中发生氨的催化氧化反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,并且要求用双线桥标明电子转移的方向与数目: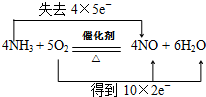
删掉.
分析 加热铂丝一段时间后,通入NH3和O2,装置A硬质玻璃管中发生氨的催化氧化反应生成一氧化氮和水,依据氧化还原反应用双线桥标明电子转移的方向与数目.
解答 加热铂丝一段时间后,通入NH3和O2,装置A硬质玻璃管中发生氨的催化氧化反应生成一氧化氮和水,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,元素化合价-3价变化为+2价,氧气中氧元素化合价0价并不会为-2价,用电子转移双线桥法标注化学方程式为: ;
;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O; ;
;
点评 本题考查学生氨气的化学性质,注意氧化还原反应中电子转移知识的应用是关键,难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
2.下列指定反应的离子方程式不正确的是( )
| A. | 醋酸钠溶液可使酚酞试液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | NaHS水解:HS-+H2O═S2-+H3O+ | |
| C. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 向AgCl的悬浊液中滴入少量Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
19.向10mL 0.1mol/L NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c ( NH4+)>c ( Al3+) | |
| B. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c ( NH4+)>c ( SO42-) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c ( OH-)<c ( AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c ( OH-)=c ( Ba2+) |
6.下列说法正确的是( )
| A. | 铅蓄电池放电时负极质量减少 | |
| B. | 在海轮外壳连接镁合金保护外壳不受腐蚀 | |
| C. | 对于同一个化学反应,一步完成和分步完成其反应的焓变亦不相同 | |
| D. | 反应 MnO4-+H2O2+H+═Mn2++H2O+O2(未配平)中每生成1 mol O2转移2 mol e- |
16.如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
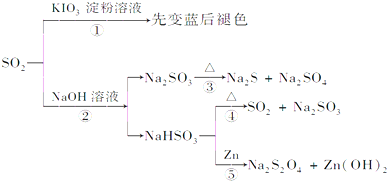

| A. | 反应①说明SO2具有漂白性,反应②说明SO2具有酸性 | |
| B. | 反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 | |
| C. | 反应③④⑤均属于氧化还原反应 | |
| D. | 工业上可利用反应②和反应④回收SO2 |
3.取部分氧化的Fe-Cu合金样品(含Fe2O3、CuO)共5.76g,经如图处理.下列说法正确的是( )

| A. | 未氧化前合金的质量为5.44g | B. | V=448,它是H2和SO2的混合气体 | ||
| C. | 样品中CuO的质量为4.0g | D. | 滤液A中的阳离子为Fe2+、Fe3+、H+ |
20.下列指定反应的离子方程式正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
