题目内容
18.HF的电离过程中,升高温度,电离平衡正向(填“正向”“逆向”“不”下同)移动,加入NaF固体,平衡逆向移动.室温下,在纯水中加入0.1mol/L HCl,水的电离平衡逆向移动,若加入0.1mol/L NH4Cl,水的电离平衡正向移动.分析 HF的电离过程是吸热反应,所以升高温度,促进电离;加入NaF固体,F-的浓度变大,平衡逆向移动;强酸强碱对水的电离起抑制作用,含有弱离子的盐对水的电离起促进作用,由此分析解答.
解答 解:HF的电离过程是吸热反应,所以升高温度,促进电离,所以电离平衡正向移动;加入NaF固体,F-的浓度变大,平衡逆向移动;强酸强碱对水的电离起抑制作用,所以在纯水中加入0.1mol/L HCl,水的电离平衡逆向移动,含有弱离子的盐对水的电离起促进作用,所以加入0.1mol/L NH4Cl,水的电离平衡正向移动,故答案为:正向;逆向;逆向;正向.
点评 本题考查了电离平衡的移动、电离吸热以及外界条件对电离平衡移动的影响,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.有机物M是苯的同系物,其结构为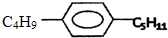 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )
 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )| A. | 6种 | B. | 12种 | C. | 24种 | D. | 32种 |
3.物质的量浓度都是0.1mol/L的下列溶液,酸性最强的是( )
| A. | HCl | B. | H2SO4 | C. | CH3COOH | D. | ( NH4)2SO4 |
7.下列描述的正确的是( )
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为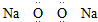 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |

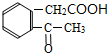 B
B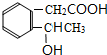 C
C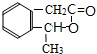
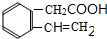 +H2O
+H2O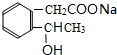 .
. 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;
;