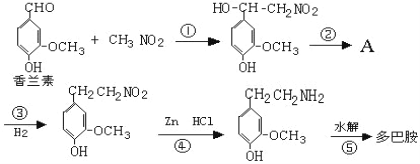
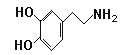
题目内容
【题目】实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂就把它们区别开来了,这种试剂是( )
A. 盐酸 B. 氢氧化钠溶液 C. 氯化钡溶液 D. 硝酸
【答案】A
【解析】选择一种试剂将Na2CO3、NaCl、AgNO3区别开来,实验时要产生不同现象,盐酸与碳酸钠反应,产生二氧化碳气体,盐酸与硝酸银反应有白色的氯化银沉淀生成,盐酸与氢氧化钠溶液混合无现象,故盐酸可以将Na2CO3、NaCl、AgNO3鉴别出来,A正确。

【题目】配制500 mL 0.25 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为_______________。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将________(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_________________________________。
假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示)。
砝码质量/g | 50 | 20 | 20 | 10 | 5 |
称量(取用砝 码过程) |
![]()
____________
(3)配制方法:某同学设计了四个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿玻璃棒注入________中。
③继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm。
④改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
若按上述步骤配制溶液物质的量浓度会________(填“偏高”“偏低”或“无影响”)。若无影响下面不用填写,若有影响,应在步骤________和步骤________之间,补充的操作是____________。
【题目】高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:______________________。
(2)装置B的作用是_______________________。如果B中长颈漏斗液面上升,则说明____________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入________。(选a或b或c)
a | b | c | |
I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氧的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是_______________________________。该现象______(填“能”或“不能”)说明溴的非金属性强于碘,原因是______________________________________。