题目内容
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
A
解析:①是硫元素,②是磷元素,③是氟元素;
三者在周期表中的位置:
| 第二周期 |
|
| F |
| 第三周期 | P | S |
|
同周期,由左到右,第一电离能呈增大趋势,但某些地方出现曲折变化,如:P>S,
同周期,由上到下,第一电离能呈减小趋势,故A正确;
原子半径:②>①>③,故B错误;
电负性:③>①>②,故C错误;
最高正化合价:①>②>③(氟无正价),故D错误;

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
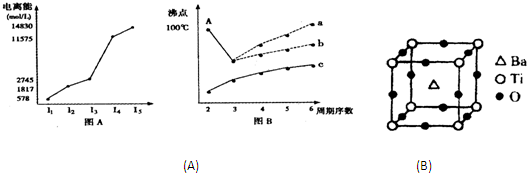
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第