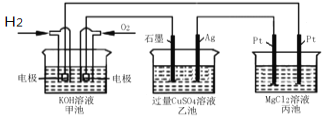
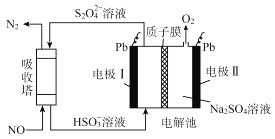
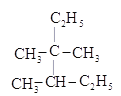题目内容
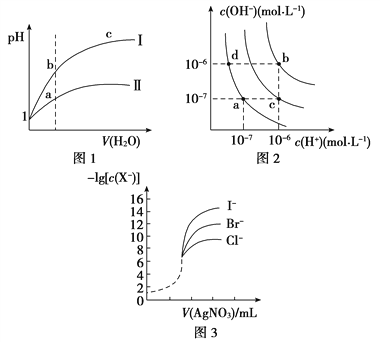
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化 如图所示。下列叙述中正确的是 ( )
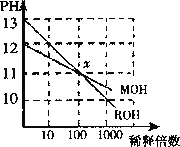
A.ROH是一种强碱
B.在x点,MOH完全电离
C.在x点,c(M+)>c(R+)
D.稀释前,c(ROH)=10c(MOH)
【答案】A
【解析】
A.由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,故A正确;
B.MOH为弱碱,任何时候都不能完全电离,故B错误
C.由ROH═R++OH-,MOHM++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故C错误;
D.稀释前,c(ROH)=0.1mol/L,MOH为弱碱所以c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故答案为A。

练习册系列答案
相关题目
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%