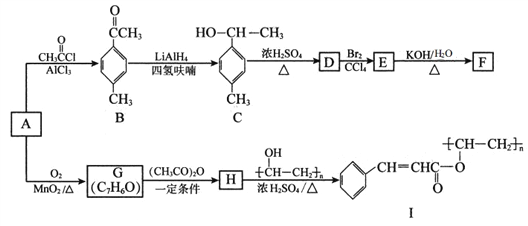
题目内容
【题目】(1) 常温下,向 1 L 0.1 mol·L-1 的的醋酸溶液中加入0.1 mol醋酸钠固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动;溶液中c (CH3COO-)·c(H+) / c (CH3COOH) 的值 __________(填“增大”、“减小”或“不变”)。
(2)常温时,测得0.1 mol·L-1 Na2A 溶液的pH=7。
① H2A在水溶液中的电离方程式为 ______________________ 。
② 该温度下,将0.01 mol·L-1 H2A溶液稀释20倍后,溶液的pH= _______ 。
③ 体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 _________ 。(填序号)
A 、盐酸多 B、 H2A多 C、一样多 D、无法确定
【答案】 逆 不变 H2A = 2H+ + A2- 3 C
【解析】(1)在醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入醋酸钠,醋酸根离子浓度增大对醋酸的电离平衡逆移;Ka=![]() ,Ka不随浓度的变化而变化,只受温度影响,所以溶液中
,Ka不随浓度的变化而变化,只受温度影响,所以溶液中![]() 的值不变;故答案为:逆;不变;
的值不变;故答案为:逆;不变;
(2)在25℃时,Kw=1.0×10-14,该温度下纯水的pH=7,测得0.1molL-1 Na2A溶液的pH=7,说明Na2A是强酸强碱盐。
①H2A是强酸,在水溶液里完全电离,其电离方程式为H2A═2H++A2-,故答案为:H2A═2H++A2-;
②该温度下,将0.01molL-1 H2A溶液稀释到20倍后,溶液中氢离子浓度=0.01mol/L×2÷20=0.001mol/L,所以pH=3;故答案为:3;
③ 体积相等、pH=1的盐酸与H2A溶液中含有的氢离子的物质的量相等,分别与足量的Zn反应,产生的氢气 一样多,故选C。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案