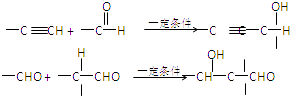题目内容
【题目】NaCl、NaOH、Na2CO3和NaHCO3均是重要的化工原料,相互间可以发生转化,请回答以下问题:

(1)粗盐经溶解、过滤和蒸发操作后,仍含有MgCl2及Na2SO4等可溶性杂质,请写出检验其中是否含有![]() 的离子方程式:____________________________。
的离子方程式:____________________________。
(2)实验室要配制480mL0.2mol/L的NaOH溶液,需要称量NaOH固体的质量为__________g。
(3)如图,实验一是为了比较Na2CO3和NaHCO3的热稳定性,则试管A中所盛的药品为____________(填化学式),能证明热稳定性强弱的现象为_____________,试管中发生反应的化学方程式为_______________。
(4)实验二是为了探究Na2O2与CO2的反应,写出该反应的化学方程式___________________。
(5)向饱和的Na2CO3溶液中通入CO2的现象为____________________________________,写出发生反应的离子方程式______________________________________。
【答案】 Ba2++ SO42-![]() BaSO4 ↓ 4.0 NaHCO3 烧杯I中无现象,烧杯中II中有浑浊出现 2NaHCO3
BaSO4 ↓ 4.0 NaHCO3 烧杯I中无现象,烧杯中II中有浑浊出现 2NaHCO3![]() Na2CO3+H2O+CO2↑ 2Na2O2+2CO2
Na2CO3+H2O+CO2↑ 2Na2O2+2CO2![]() 2Na2CO3+O 2 有白色晶体析出 CO2 +CO32-+ H2O
2Na2CO3+O 2 有白色晶体析出 CO2 +CO32-+ H2O![]() 2HCO3-
2HCO3-
【解析】(1)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰,即先加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-,发生的离子反应为Ba2++ SO42-![]() BaSO4 ↓;(2)没有480mL容量瓶,选择容量稍大体积接近的容量瓶,故应选择500mL容量瓶,所需氢氧化钠的质量为0.5L×0.2molL-1×40g/mol=4.0g;(3)试管A中所盛的药品为NaHCO3,该实验中,直接加热的碳酸钠不分解,但间接加热的碳酸氢钠分解,所以说明二者中热稳定性强的物质是Na2CO3,碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3
BaSO4 ↓;(2)没有480mL容量瓶,选择容量稍大体积接近的容量瓶,故应选择500mL容量瓶,所需氢氧化钠的质量为0.5L×0.2molL-1×40g/mol=4.0g;(3)试管A中所盛的药品为NaHCO3,该实验中,直接加热的碳酸钠不分解,但间接加热的碳酸氢钠分解,所以说明二者中热稳定性强的物质是Na2CO3,碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,生成的二氧化碳能使II中的澄清的石灰水变浑浊,而I中的澄清的石灰水无变化,故现象为:烧杯I中无现象,烧杯中II中有浑浊出现;(4)Na2O2与CO2的反应,反应生成碳酸钠和氧气,氧气助燃,棉花燃烧,Na2O2与CO2的反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2;(5)碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现(或有晶体析出),反应的方程式为CO32-+CO2+H2O═2HCO3-。
Na2CO3+H2O+CO2↑,生成的二氧化碳能使II中的澄清的石灰水变浑浊,而I中的澄清的石灰水无变化,故现象为:烧杯I中无现象,烧杯中II中有浑浊出现;(4)Na2O2与CO2的反应,反应生成碳酸钠和氧气,氧气助燃,棉花燃烧,Na2O2与CO2的反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2;(5)碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现(或有晶体析出),反应的方程式为CO32-+CO2+H2O═2HCO3-。