题目内容
下列物质中氧原子数目与15.6 g Na2O2中氧原子数一定相等的是
| A.6.72 L CO | B.6.6 g CO2 | C.8 g SO3 | D.9.8 g H2SO4 |
D
试题分析:15.6 g Na2O2的物质的量=15.6g÷78g/mol=0.2mol,其中氧原子的物质的量=0.2mol×2=0.4mol。要满足氧原子数相等,则氧原子的物质的量必然相等。A、6.72 L CO的状态不能确定,无法计算物质的量,A不正确;B.6.6 g CO2的物质的量=6.6g÷44g/mol=0.15mol,其中氧原子的物质的量=0.15mol×2=0.3mol,B不正确;C.8 g SO3的物质的量=8.0g÷80g/mol=0.1mol,其中氧原子的物质的量=0.1mol×3=0.3mol,C不正确;D.9.8 g H2SO4的物质的量=9.8g÷98g/mol=0.1mol,其中氧原子的物质的量=0.1mol×4=0.4mol,D正确,答案选D。

练习册系列答案
相关题目
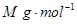 )溶于ag水中,所得溶液的密度为
)溶于ag水中,所得溶液的密度为 ,物质的量浓度为
,物质的量浓度为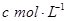 ,则该气体溶入水中的体积是
,则该气体溶入水中的体积是



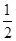 c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是