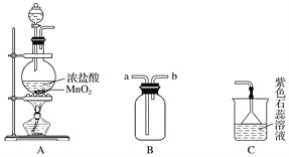
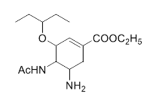
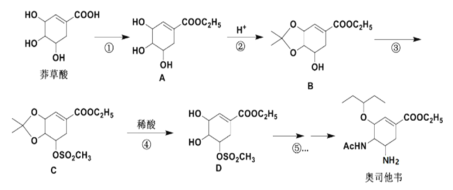
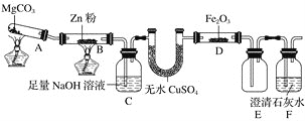
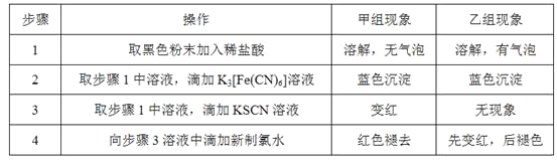
题目内容
【题目】磷酸氯喹用于治疗对氯喹敏感的恶性疟、间日疟及三日疟。若干位药物研发和临床专家研究发现,该药物在细胞水平上能有效抑制新型冠状病毒的感染。
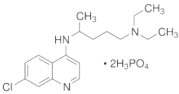
(1)磷酸氯喹是由多种元素形成的物质,其中氯元素的基态氯原子,电子占据的最高能层符号为_____;磷元素的简单氢化物PH3的中心原子杂化方式是_____,属于_______(填“极性”或“非极性”)分子;其他的四种元素的第一电离能从大到小的顺序为_________。
(2)N与P为同族元素,比较其最高价氧化物的水化物酸性并从结构的角度说明理由:________
(3)H3PO4与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+的核外电子排布式为___________;![]() 做为配体为铁离子提供______。
做为配体为铁离子提供______。
(4)磷化铜(Cu3P2)用于制造磷青铜。磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件,其晶胞结构如图所示:
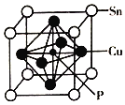
①其化学式为__________
②铜或铜盐的焰色反应为_____色,金属元素能产生焰色实验的微观原因为______。
③若晶体密度为ρg/cm3,摩尔质量为Mg/mol,NA代表阿伏加德罗常数,则最近的Cu原子核间距为________________pm。
【答案】M sp3 极性 N>O>C>H 硝酸大于磷酸,因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个,且N原子的吸引电子能力比较强,使得R-O-H的电子偏向N原子,使得-O-H更容易电离出H+ 1s22s22p63s23p63d5 孤电子对 SnCu3P 绿 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量 ![]() ×
×![]() ×10-10
×10-10
【解析】
(1)氯元素为17号元素,根据其核外电子排布式判断其最高能级;根据价层电子对互斥理论判断杂化方式,正负电荷中心不重合的分子为极性分子;
(3)铁元素为26号元素,失去4s能级两个电子和3d能级一个电子形成铁离子;配合物中一般由金属元素提供空轨道,非金属元素提供孤电子对;
(4)①根据均摊法分析化学式;
③根据晶胞结构可知Cu原子核最近距离为面对角线的一半。
(1)基态氯原子的核外电子排布式为1s22s22p63s23p5,占据的最高能层为第3层,能层符号为M;PH3中心原子的价层电子对数为![]() =4,所以为sp3杂化,分子中有一对孤电子对,所以分子的空间构型为三角锥形,P原子位于顶点,所以其正负电荷中心不重合,为极性分子;其他四种元素分别为H、C、O、N,H原子容易失去电子,第一电离能较小,一般来讲同周期主族元素自左至右第一电离能呈增大趋势,但N原子最外层为半满状态,更稳定,第一电离能较大,所以四种元素第一电离能大小关系为N>O>C>H;
=4,所以为sp3杂化,分子中有一对孤电子对,所以分子的空间构型为三角锥形,P原子位于顶点,所以其正负电荷中心不重合,为极性分子;其他四种元素分别为H、C、O、N,H原子容易失去电子,第一电离能较小,一般来讲同周期主族元素自左至右第一电离能呈增大趋势,但N原子最外层为半满状态,更稳定,第一电离能较大,所以四种元素第一电离能大小关系为N>O>C>H;
(2)因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个,且N原子的吸引电子能力比较强,使得R-O-H的电子偏向N原子,使得-O-H更容易电离出H+,所以硝酸的酸性大于磷酸;
(3)基态Fe原子的核外电子排布式为1s22s22p63s23p63d,64s2,失去最外层3个电子形成铁离子,所以Fe3+的核外电子排布式为1s22s22p63s23p63d5;![]() 作为配体提供孤电子对;
作为配体提供孤电子对;
(4)①根据均摊法,晶胞中Sn原子的个数为![]() =1,P原子的个数为1,Cu原子的个数为
=1,P原子的个数为1,Cu原子的个数为![]() =3,所以化学式为SnCu3P;
=3,所以化学式为SnCu3P;
②铜或铜盐的焰色反应为绿色;电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,所以金属元素可以产生焰色反应;
③该晶胞含有1个Sn原子,1个P原子,3个Cu原子,该物质的摩尔质量为M,所以晶胞的质量为![]() g,设晶胞的棱长为a,则晶胞的体积为a3,所以晶胞的密度ρ=
g,设晶胞的棱长为a,则晶胞的体积为a3,所以晶胞的密度ρ=![]() ,可以解得a=
,可以解得a=![]() cm=
cm=![]() ×10-10pm,距离最近的Cu原子的间距为面对角线的一半,所以为
×10-10pm,距离最近的Cu原子的间距为面对角线的一半,所以为![]() ×
×![]() ×10-10pm。
×10-10pm。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验方案中,可以达到实验目的的是
选项 | 实验操作与现象 | 目的或结论 |
A | 用pH试纸分别测定相同温度和相同浓度的CH3COONa溶液和NaClO溶液的pH | 验证酸性:CH3COOH>HClO |
B | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
C | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解 |
|
D | 向NaI、NaCl混合稀溶液中滴加少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【题目】已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
0.1mol·Lˉ1KI溶液 | H2O | 0.01mol·Lˉ1X溶液 | 0.1mol·Lˉ1双氧水 | 1mol·Lˉ1稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=___,n=___。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>___,才确保看到蓝色。
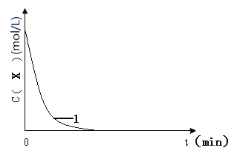
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注)。____
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂___(填“提高”或“降低”)了反应活化能。