题目内容
【题目】某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
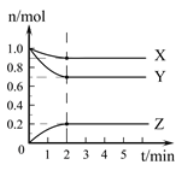
(1)反应开始至2 mim,Y的平均反应速率_________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
(3)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
【答案】 0.075 X+3Y![]() 2Z 是
2Z 是
【解析】(1)据v=△n/(V·△t)计算反应速率;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据平衡时物质的浓度不再发生变化判断。
(1)反应开始至2 min时,Y的物质的量减少了1.0mol-0.7mol=0.3mol,所以反应速率是0.3mol/(2L×2min)=0.075mol/(Lmin);
(2)根据图象可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且2min时变化量分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,则其方程式为X+3Y![]() 2Z;
2Z;
(3)当反应进行了3 min时各种物质的物质的量不再发生变化,即浓度不再发生变化,因此该反应已经达到平衡状态。

练习册系列答案
相关题目

