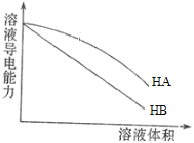
��Ŀ����
����Ŀ����12�����ߴ�������[��ѧʽ��Sr(NO3)2]���������źŵơ���ѧ�����ȡ�
������ҵ���������г���������ơ����ᱵ�����ʣ���������ƿ�����Ũ���ᣬ�������ȡ����ᱵ������Ũ���ᡣ�ᴿ�����ȵ�ʵ�鲽�����£�
��ȡ�����ʵ���������Ʒ�������м���ŨHNO3�ܽ⣬���衣
�����ˣ�����ŨHNO3ϴ��������
������������ˮ�У����Թ�������ʹBa2+���������ú�����£�N2H4�����������ỹԭ������pH��7��8�����ˡ�
������Һ���������pH��2��3������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӡ�
�����õ���Sr(NO3)2��2H2O������100 �������¸���õ��ߴ������ȡ�
��1����������ŨHNO3ϴ��������Ŀ���� ��
��2�����������£�N2H4�����������ᣨCrO3����ԭΪCr3+��ͬʱ����һ����ɫ��ζ�����壬д���÷�Ӧ�����ӷ���ʽ ��
��3���¾��кܺõĻ�ԭ�ԣ���������������Ⱦ���ʿ����ڳ�ȥ��¯���豸��ˮ�е��ܽ����ȣ���ȥ100L��¯ˮ��������8g/L�����ܽ�������Ҫ�µ�����Ϊ ��
����Sr(NO3)2�����ֽ⣬����Sr(NO2)2��O2����500 ��ʱSr(NO2)2��һ���ֽ�����SrO���������ȡһ��������Sr(NO2)2��Sr(NO3)2��Ʒ����������ȫ�ֽ⣬�õ�5.20 g SrO�����5.08 g������塣�������Ʒ��Sr(NO3)2������������д��������̣� ����ȷ��0.01����
���𰸡�
������1����ȥ���ʼ��������ȵ��ܽ���ʧ��2�֣�
��2��3N2H4 + 4CrO3+12H+=3N2��+ 4Cr3++12H2O��2�֣�
��3��800g��2����
����m(��Ʒ)= 5.20 g+5.08 g=10.28 g
n(SrO)= ![]() =0.05 mol
=0.05 mol
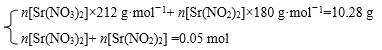
�����n[Sr(NO3)2] =0.04 mol
n[Sr(NO2)2] =0.01 mol
w[Sr(NO3)2] =![]() ��100%=82.49%��6�֣�
��100%=82.49%��6�֣�
��������
���������
������1�������Ȳ�����Ũ���ᣬ��Ũ����ϴ���ܳ�ȥ�ܽ������ƣ����ܼ������ܽ���ʧ����2��
��Ӧ����Ϊ������3N2H4 + 4CrO3+12H+=3N2��+ 4Cr3++12H2O����3�����ݵ����غ�ȷ��N2H4 ~O2����Ħ��������ͬ�������������������µ�������
�������������غ�ó���ϵʽ n[Sr(NO3)2]��212 g��mol��1+ n[Sr(NO2)2]��180 g��mol��1=10.28 g
������Ԫ���غ�ó���ϵʽΪn[Sr(NO3)2]+ n[Sr(NO2)2] =![]() =0.05 mol���������
=0.05 mol���������

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�