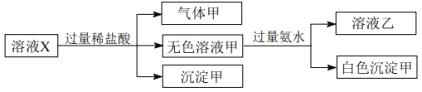
��Ŀ����
����Ŀ������11.2gKOH��ϡ��Һ��1L0.1mol��L��1��H2SO4��Һ��Ӧ���ų�11.46kJ�������������Ȼ�ѧ����ʽ��ȷ���ǣ�������
A. KOH��aq��+![]() H2SO4��aq���T
H2SO4��aq���T![]() K2SO4��aq��+H2O��l����H=��11.46 kJ��mol��1
K2SO4��aq��+H2O��l����H=��11.46 kJ��mol��1
B. 2KOH��aq��+H2SO4��aq���TK2SO4��aq��+2H2O��l����H=��11.46 kJ��mol��1
C. 2KOH��aq��+H2SO4��aq���TK2SO4��aq��+2H2O��l����H=+114.6 kJ��mol��1
D. KOH��aq��+![]() H2SO4��aq���T
H2SO4��aq���T![]() K2SO4��aq��+H2O��l����H=��57.3 kJ��mol��1
K2SO4��aq��+H2O��l����H=��57.3 kJ��mol��1
���𰸡�D
��������11.2gKOH��11.2g��56g/mol��0.2mol��1L0.1mol��L��1��H2SO4��Һ����������0.2mol������ǡ�÷�Ӧ����0.2molˮ����Ӧ�ų�11.46kJ����������������1molˮ������57.3kJ������Ȼ�ѧ����ʽΪKOH��aq��+1/2H2SO4��aq��=1/2K2SO4��aq��+H2O��l����H=��57.3 kJ��mol��1��
2KOH��aq��+H2SO4��aq����K2SO4��aq��+2H2O��l����H=��114.6 kJ��mol��1����ѡD��

��ϰ��ϵ�д�
�����Ŀ